 Un des sujets fréquemment débattu a été le caractère cytotoxique de la protéine Spike ,en particulier sur les endothelium vasculaires.La cytotoxicité a été démontrée par les travaux du Salk institute de San Diego
Un des sujets fréquemment débattu a été le caractère cytotoxique de la protéine Spike ,en particulier sur les endothelium vasculaires.La cytotoxicité a été démontrée par les travaux du Salk institute de San Diego
A partir de cette certitude,la reflexion doit porter sur la quantité de protéine spike synthétisée par nos cellules musculaires et nos ganglions lymphatiques loco-régionaux en réponse à l’injection d’ARNm.Questions connexes: durée de présence de la protéine spike dans notre corps après l’injection, celà dépend de plusieurs facteurs, dont la rapidité de mise en jeu de la réponse immunitaire(phagocytose des protéines spike circulantes,destruction des cellules fabricant la protéine Spike,après reconnaissance par le système immunitaire) .Autre question:la doxa des laboratoires et des autorités sanitaires prétend que les cellules »détournées » par le vaccin et fabriquant Spike disparaissent très vite, en quelques jours.Est-ce certain?Par ailleurs , le suivi des micro goutelettes lipidiques contenant l’ARNm, chez le hamster, modèle animal très proche de l’homme,après vaccination, en retrouve dans de nombreux organes dont ,outre le muscle,et les ganglions lymphatiques, le foie, les reins, le coeur, les ovaires,le système nerveux.
Imaginons par ailleurs une réponse immunitaire faible, et prolongée comme dans les hépatites B chroniques, il pourrait y avoir une lyse chronique des cellules synthétisant spike et une pérénisation d’ une synthèse de spike,et donc une cytotoxicité chronique .Celà pourrait expliquer ce que de nombreux praticiens ont observé après vaccination, des symptômes rappellant ceux du Covid.
Ce ne sont que des hypothèses mais on aimerait plus de discussion,et de recherches et moins de slogans lénifiants.
Décès c’est grave, toujours.
Le choc anaphylactique peut-être considéré comme un aléa.
Mais les Thromboses, infarctus, paralysies, etc… gravissimes, itératives sont inacceptables. Quelque soit le pourcentage.
Effets Adverses:
Europe (Addreport): 950 000
USA (VAERS):
701 559 effets secondaires.
60 741 hospitalisations
80 393 Soins d’urgence
6 637 Crises cardiaques
5 765 myocardites
1 862 Fausses couches
19 210 Invalidités
14 925 Décès
Ce ne sont que du déclaratif. La réalité est peut-être 10 fois supérieure …
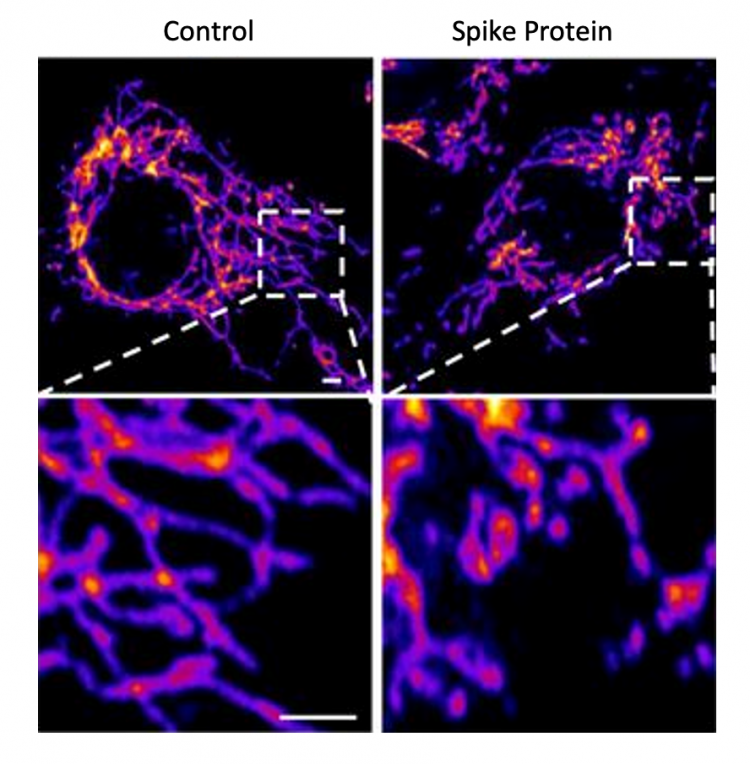
La protéine de pointe du nouveau coronavirus joue un rôle clé supplémentaire dans la maladie Des chercheurs et collaborateurs de Salk montrent comment la protéine endommage les cellules, confirmant que COVID-19 est une maladie principalement vasculaire LA JOLLA – Les scientifiques savent depuis un certain temps que les protéines « pics » distinctives du SRAS-CoV-2 aident le virus à infecter son hôte en se fixant sur des cellules saines. Maintenant, une nouvelle étude majeure montre que les protéines de pointe du virus (qui se comportent très différemment de celles codées en toute sécurité par les vaccins) jouent également un rôle clé dans la maladie elle-même. L’article, publié le 30 avril 2021 dans Circulation Research, montre également de manière concluante que COVID-19 est une maladie vasculaire, démontrant exactement comment le virus SARS-CoV-2 endommage et attaque le système vasculaire au niveau cellulaire. Les résultats aident à expliquer la grande variété de complications apparemment sans lien de COVID-19 et pourraient ouvrir la porte à de nouvelles recherches sur des thérapies plus efficaces. Des images représentatives de cellules de contrôle endothéliales vasculaires (à gauche) et de cellules traitées avec la protéine Spike SARS-CoV-2 (à droite) montrent que la protéine spike provoque une fragmentation mitochondriale accrue dans les cellules vasculaires. Cliquez ici pour une image haute résolution. Crédit : Institut Salk « Beaucoup de gens pensent qu’il s’agit d’une maladie respiratoire, mais c’est vraiment une maladie vasculaire », explique le professeur adjoint de recherche Uri Manor, co-auteur principal de l’étude. «Cela pourrait expliquer pourquoi certaines personnes ont des accidents vasculaires cérébraux et pourquoi certaines personnes ont des problèmes dans d’autres parties du corps. Le point commun entre eux est qu’ils ont tous des fondements vasculaires. Les chercheurs de Salk ont collaboré avec des scientifiques de l’Université de Californie à San Diego sur l’article, notamment le co-premier auteur Jiao Zhang et le co-auteur principal John Shyy, entre autres. Bien que les résultats eux-mêmes ne soient pas entièrement une surprise, l’article fournit une confirmation claire et une explication détaillée du mécanisme par lequel la protéine endommage les cellules vasculaires pour la première fois. Il y a eu un consensus croissant sur le fait que le SARS-CoV-2 affecte le système vasculaire, mais exactement comment il l’a fait n’a pas été compris. De même, les scientifiques étudiant d’autres coronavirus soupçonnent depuis longtemps que la protéine de pointe a contribué à endommager les cellules endothéliales vasculaires, mais c’est la première fois que le processus est documenté. Dans la nouvelle étude, les chercheurs ont créé un «pseudovirus» entouré d’une couronne classique de protéines de pointe du SRAS-CoV-2, mais ne contenant aucun virus réel. L’exposition à ce pseudovirus a entraîné des dommages aux poumons et aux artères d’un modèle animal, prouvant que la protéine de pointe suffisait à elle seule à provoquer la maladie. Des échantillons de tissus ont montré une inflammation des cellules endothéliales tapissant les parois des artères pulmonaires. L’équipe a ensuite reproduit ce processus en laboratoire, exposant les cellules endothéliales saines (qui tapissent les artères) à la protéine de pointe. Ils ont montré que la protéine de pointe endommageait les cellules en se liant à l’ACE2. Cette liaison a perturbé la signalisation moléculaire de l’ACE2 vers les mitochondries (organites qui génèrent de l’énergie pour les cellules), provoquant l’endommagement et la fragmentation des mitochondries. Des études antérieures ont montré un effet similaire lorsque les cellules étaient exposées au virus SARS-CoV-2, mais il s’agit de la première étude à montrer que les dommages se produisent lorsque les cellules sont exposées à la protéine de pointe seule. « Si vous supprimez les capacités de réplication du virus, il a toujours un effet dommageable majeur sur les cellules vasculaires, simplement en raison de sa capacité à se lier à ce récepteur ACE2, le récepteur de la protéine S, désormais célèbre grâce au COVID », explique Manor. . « D’autres études avec des protéines de pointe mutantes fourniront également de nouvelles informations sur l’infectivité et la gravité des virus mutants du SRAS CoV-2. » Les chercheurs espèrent ensuite examiner de plus près le mécanisme par lequel la protéine ACE2 perturbée endommage les mitochondries et les fait changer de forme. Les autres auteurs de l’étude sont Yuyang Lei et Zu-Yi Yuan de l’Université Jiaotong à Xi’an, en Chine ; Cara R. Schiavon, Leonardo Andrade et Gerald S. Shadel of Salk; Ming He, Hui Shen, Yichi Zhang, Yoshitake Cho, Mark Hepokoski, Jason X.-J. Yuan, Atul Malhotra, Jin Zhang de l’Université de Californie à San Diego ; Lili Chen, Qian Yin, Ting Lei, Hongliang Wang et Shengpeng Wang du Xi’an Jiatong University Health Science Center à Xi’an, Chine. La recherche a été soutenue par les National Institutes of Health, la National Natural Science Foundation of China, le Shaanxi Natural Science Fund, le National Key Research and Development Program, le premier hôpital affilié de l’Université de Xi’an Jiaotong ; et l’Université de Xi’an Jiaotong. DOI : 10.1161/CIRCRESAHA.121.318902
TRADUCTION+
The novel coronavirus’ spike protein plays additional key role in illness
Salk researchers and collaborators show how the protein damages cells, confirming COVID-19 as a primarily vascular disease
LA JOLLA—Scientists have known for a while that SARS-CoV-2’s distinctive “spike” proteins help the virus infect its host by latching on to healthy cells. Now, a major new study shows that the virus spike proteins (which behave very differently than those safely encoded by vaccines) also play a key role in the disease itself.
The paper, published on April 30, 2021, in Circulation Research, also shows conclusively that COVID-19 is a vascular disease, demonstrating exactly how the SARS-CoV-2 virus damages and attacks the vascular system on a cellular level. The findings help explain COVID-19’s wide variety of seemingly unconnected complications, and could open the door for new research into more effective therapies.
Representative images of vascular endothelial control cells (left) and cells treated with the SARS-CoV-2 Spike protein (right) show that the spike protein causes increased mitochondrial fragmentation in vascular cells.
Click here for a high-resolution image.
Credit: Salk Institute
“A lot of people think of it as a respiratory disease, but it’s really a vascular disease,” says Assistant Research Professor Uri Manor, who is co-senior author of the study. “That could explain why some people have strokes, and why some people have issues in other parts of the body. The commonality between them is that they all have vascular underpinnings.”
Salk researchers collaborated with scientists at the University of California San Diego on the paper, including co-first author Jiao Zhang and co-senior author John Shyy, among others.
While the findings themselves aren’t entirely a surprise, the paper provides clear confirmation and a detailed explanation of the mechanism through which the protein damages vascular cells for the first time. There’s been a growing consensus that SARS-CoV-2 affects the vascular system, but exactly how it did so was not understood. Similarly, scientists studying other coronaviruses have long suspected that the spike protein contributed to damaging vascular endothelial cells, but this is the first time the process has been documented.
In the new study, the researchers created a “pseudovirus” that was surrounded by SARS-CoV-2 classic crown of spike proteins, but did not contain any actual virus. Exposure to this pseudovirus resulted in damage to the lungs and arteries of an animal model—proving that the spike protein alone was enough to cause disease. Tissue samples showed inflammation in endothelial cells lining the pulmonary artery walls.
The team then replicated this process in the lab, exposing healthy endothelial cells (which line arteries) to the spike protein. They showed that the spike protein damaged the cells by binding ACE2. This binding disrupted ACE2’s molecular signaling to mitochondria (organelles that generate energy for cells), causing the mitochondria to become damaged and fragmented.
Previous studies have shown a similar effect when cells were exposed to the SARS-CoV-2 virus, but this is the first study to show that the damage occurs when cells are exposed to the spike protein on its own.
“If you remove the replicating capabilities of the virus, it still has a major damaging effect on the vascular cells, simply by virtue of its ability to bind to this ACE2 receptor, the S protein receptor, now famous thanks to COVID,” Manor explains. “Further studies with mutant spike proteins will also provide new insight towards the infectivity and severity of mutant SARS CoV-2 viruses.”
The researchers next hope to take a closer look at the mechanism by which the disrupted ACE2 protein damages mitochondria and causes them to change shape.
Other authors on the study are Yuyang Lei and Zu-Yi Yuan of Jiaotong University in Xi’an, China; Cara R. Schiavon, Leonardo Andrade, and Gerald S. Shadel of Salk; Ming He, Hui Shen, Yichi Zhang, Yoshitake Cho, Mark Hepokoski, Jason X.-J. Yuan, Atul Malhotra, Jin Zhang of the University of California San Diego; Lili Chen, Qian Yin, Ting Lei, Hongliang Wang and Shengpeng Wang of Xi’an Jiatong University Health Science Center in Xi’an, China.
The research was supported by the National Institutes of Health, the National Natural Science Foundation of China, the Shaanxi Natural Science Fund, the National Key Research and Development Program, the First Affiliated Hospital of Xi’an Jiaotong University; and Xi’an Jiaotong University.
DOI: 10.1161/CIRCRESAHA.121.318902