{AR-youtube width= »500″ height= »500″}watch?v=vzAg7IFw9H0{/AR-youtube}
Edmond Le Borgne recommande l’article ci-dessous réalisé par l’équipe Inserm UMRS 975,Cricm,Université Pierre et Marie Curie.L’étude de la douleur est un dossier de santé publique ,Edmond Le Borgne vice Président de IUE International Union Endovascular à la mission de créer un groupe de réflexion .
Dossier réalisé en collaboration avec Michel Pohl équipe « Douleurs » Inserm UMRS 975, Cricm, Université Pierre et Marie Curie – Juillet 2011.
Selon la définition officielle de l’Association internationale pour l’étude de la douleur (IASP), « la douleur est une expérience sensorielle et émotionnelle désagréable associée à une lésion tissulaire réelle ou potentielle ou décrite dans ces termes« . Elle est donc subjective et repose avant tout sur le ressenti du patient, ce qui la rend difficile à quantifier et à qualifier. D’autant plus que la douleur n’est pas liée systématiquement à une lésion, une caractéristique qui rend son étude complexe.
De la main au cerveau
© Fotolia
Neurotransmetteurs
Il est néanmoins possible de décrire le parcours de l’information douloureuse dans l’organisme, avec l’exemple de la douleur aiguë provoquée par une main posée par inadvertance sur une plaque brûlante. La brûlure va stimuler les terminaisons nerveuses cutanées, qui sont également présentes dans d’autres tissus (les muscles, les articulations, les viscères etc). Après avoir été stimulées, ces terminaisons vont transmettre un message nerveux via des nerfs spécialisés : les nocicepteurs. L’information est ensuite transmise à la moelle épinière, site des premiers relais nerveux, puis au cerveau.
Une fois arrivé au cerveau, le signal est identifié en « douleur ». Cependant, avant même ce décryptage du signal douloureux, la main a été dégagée de la source de chaleur, grâce à un arc réflexe situé au sein de la moelle épinière. C’est également à ce niveau que les premiers systèmes de protection anti-douleur, impliquant leneurotransmetteur GABA ou les endomorphines, interviennent. Malheureusement, dans certaines conditions, d’autres systèmes endogènes peuvent également exacerber l’information douloureuse.
La douleur aiguë joue donc un rôle d’alarme qui va permettre à l’organisme de réagir et de se protéger face à un stimulus mécanique, chimique ou thermique. En revanche, quand la douleur est chronique, ce mécanisme d’alarme n’est plus justifié. La douleur devient dans ce cas pathologique ; on parle alors de maladie à part entière.
Le syndrome d’insensibilité congénital à la douleur (ICD)
Très rare, le syndrome d’insensibilité à la douleur (ICD) se caractérise par une absence ou une diminution très forte de la sensation douloureuse depuis la naissance. Cette maladie d’origine génétique provoque la plupart du temps une atteinte des fibres nerveuses transmettant l’information douloureuse. L’étude des rares cas de patients atteints de cette maladie permet aux chercheurs en élucidant les mécanismes d’absence de douleur d’améliorer la compréhension de la douleur normale.Douleur inflammatoire, neuropathique ou cancéreuse ?
Habituellement, la douleur est divisée en deux catégories en fonction de la durée. La douleur aiguë est intense mais souvent brève, c’est ce qu’on ressent en se coupant le doigt, par exemple. La douleur est dite chronique ou pathologique, lorsque la sensation douloureuse excède trois mois et devient récurrente : certaines douleurs musculaires, migraines ou encore douleurs associées à des lésions nerveuses.
© Fotolia
Le trajet de la douleur
Trois formes de douleurs chroniques peuvent être distinguées selon les mécanismes physiologiques en jeu :
- les douleurs inflammatoires qui recouvrent toutes les douleurs associées aux phénomènes d’inflammation : lésions, arthrose, etc.
- les douleurs neuropathiques associées à des atteintes du système nerveux central et périphérique : lésion de la moelle épinière, du nerf sciatique, etc.
- les douleurs cancéreuses qui associent souvent une composante inflammatoire et neuropathique. Paradoxalement, certains traitements anti-tumoraux peuvent également déclencher des neuropathies périphériques.
La douleur est subjective puisqu’elle peut être ressentie de façon extrêmement différente en fonction des individus mais aussi pour une même personne selon son environnement. Cette différence s’explique par le lien étroit entre la douleur et le contexte psycho-social. En effet, l’imagerie cérébrale a permis de montrer que les centres cérébraux responsables de la perception de la douleur sont étroitement liés aux centres des émotions. Ce lien a également été mis en évidence par des études montrant qu’un individu dont l’attention est sollicitée ressentira moins la douleur qu’un individu focalisé sur l’événement douloureux (*).
De 15 à 25% de la population victime de douleurs chroniques
Bien que les études épidémiologiques de la douleur ne soient pas aisées, faute d’outils de diagnostic simples, consensuels et fiables, et du caractère subjectif de la douleur, on peut néanmoins extraire un certain nombre d’enseignement des études existantes.
La douleur chronique concernerait 15 à 25% de la population. Elle augmente avec l’âge, concerne préférentiellement les femmes et les catégories socio-professionnelles les plus faibles.
- principales localisations : dos, cou-épaules, membres, tête, abdomen
- principales causes : os, muscles, articulations
- fréquemment associée à : dépression, anxiété, troubles du sommeil, altération de la qualité de vie
Ainsi, lorsqu’on interroge les patients, 18 à 50% des personnes ont présenté une douleur liée à une lombalgie au cours de l’année précédente, 20% des femmes et 7% des hommes des douleurs migraineuses, et jusqu’à 95% des individus si l’on considère les maux de tête dans leur globalité.
La douleur a donc un coût socio-économique élevé de par son impact sur la qualité de vie et les recours au système de soins qu’elle induit.La migraine, cas typique de douleur
En France, près de 11 millions de personnes sont touchées par la migraine. Cette affection entraîne des douleurs chroniques, des « crises » souvent insupportables qui disparaissent et reviennent régulièrement sans raison. Leur durée varie de quelques heures à plusieurs jours. Les migraines handicapent la vie quotidienne des patients, pendant des mois, voire des années. Les chercheurs ont mis en évidence des facteurs génétiques, mais ignorent les causes de son déclenchement. Depuis les années 1990, des médicaments efficaces ont été découverts dans le traitement des crises de migraine : les triptans. Ces derniers sont proposés lorsque les antalgiques habituels ne fonctionnent pas. Ils sont parfois associés à des traitements de fond visant à réduire la fréquence des crises.Soulager la douleur
Les médicaments
© Fotolia
Douleurs aux articulations
Les douleurs inflammatoires sont aujourd’hui bien prises en charge, grâce aux antalgiques de référence : le paracétamol, l’aspirine ou encore la morphine et ses dérivés, pour les douleurs les plus rebelles. Ces médicaments sont efficaces contre des douleurs aiguës, mais présentent des effets secondaires non négligeables s’ils sont utilisés de façon prolongée, voire chronique (troubles gastriques et rénaux, tolérance et dépendance à la morphine ).
Les douleurs neuropathiques, liées le plus souvent à une lésion du système nerveux, répondent très mal aux antalgiques précédents, exceptés certainsopioïdes. Mais les effets secondaires de ces derniers à long terme ne permettent pas de les utiliser pour des douleurs chroniques. Les seuls traitements aujourd’hui utilisés sont les antidépresseurs ainsi que les antiépileptiques. Ces deux types de médicaments ont une action antalgique différente et présentent moins d’effets indésirables. Mais ils ont une efficacité modérée chez pratiquement 50% des patients. Les médecins se retrouvent donc démunis devant les autres patients. D’où la nécessité de trouver d’autres pistes thérapeutiques.
Les traitements non pharmacologiques
De nombreuses prises en charge non médicamenteuses sont aujourd’hui admises par le champ médical. Acupuncture, relaxation, sophrologie, placebo, ou encore hypnose, autant de méthodes qui ont prouvé leur efficacité, notamment via des techniques d’imagerie cérébrale. Elles ont d’ailleurs pris une place importante dans les centres antidouleur et permettent même parfois de diminuer les prises médicamenteuses de certains patients.
La mesure de la douleur
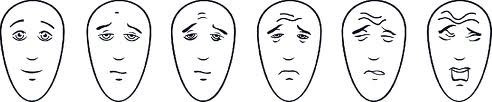
Bien que la douleur soit subjective, puisqu’elle repose sur un ressenti personnel, il existe néanmoins des outils pour l’évaluer, afin d’aider les équipes médicales à adapter le traitement. Ces outils diagnostiques reposent sur des questionnaires d’échelles de douleur, pour mesurer l’intensité de la douleur et son impact sur la qualité de vie des patients. Pour les adultes, l’échelle la plus souvent utilisée est l’échelle numérique, graduée de 0 pour une absence de douleur, à 10 pour la douleur maximale imaginable. Pour les enfants, les médecins utilisent une échelle avec des visages.Echelle « FPS » Face Pain Scale
La recherche très active dans le champ de la douleur
La recherche sur la douleur est très active dans le monde et en France. Le « Réseau Inserm de Recherches sur la Douleur » regroupe une trentaine d’équipes françaises autour de thématiques de recherche tant fondamentales que cliniques. Ces dernières années ont vu naître de grandes avancées dans la compréhension de la douleur, en particulier dans les mécanismes en jeu dans la douleur chronique.
L’équipe « Douleurs », de l’unité Inserm UMRS 975 a notamment montré que la douleur n’est pas uniquement neurologique (**) et que les cellules gliales du système nerveux central et certaines cellules immunitaires sont fondamentalement impliquées dans l’apparition des douleurs neuropathiques en particulier. Certaines fonctions gliales étant altérées, les cellules sécrètent des substances (glio-transmetteurs) qui stimulent les neurones sensoriels et exacerbent donc la douleur. L’identification de ces nouveaux acteurs majeurs de la douleur chronique offre des pistes prometteuses pour l’élaboration de nouveaux médicaments.
La découverte de la « sensibilisation périphérique et centrale » (***), phénomène majeur dans la douleur, a permis de comprendre qu’après une intervention ou une lésion nerveuse, le système devient, et parfois reste, hypersensible à la douleur. Cela explique en partie pourquoi des événements douloureux postérieurs, sans lien avec le précédent, peuvent être ressentis de façon exacerbée chez certains patients.
Malgré ces étapes majeures accomplies dans la compréhension des mécanismes de la douleur, des études fondamentales et cliniques sont nécessaires pour permettre la mise en place et la découverte de nouveaux traitements. Néanmoins l’identification de nouvelles cibles thérapeutiques est un réel espoir pour la recherche de nouvelles molécules.
© Image reprise de : Peyron et al., Neurology (2004), 63 : 1838-1846.
Etude des réponses cérébrales à la douleur
Douleur et imagerie cérébrale
Les techniques d’imagerie cérébrale et notamment l’IRM fonctionnelle (IRM-f) ont indéniablement permis à la recherche sur la douleur de franchir une étape importante. En effet, grâce à l’imagerie, la douleur a pu être identifiée, visualisée, voire quantifiée au niveau cérébral, permettant, en particulier, de traduire en images les liens étroits entre douleur et émotion.Références
* Roy M, Lebuis A, Peretz I, Rainville P (2010) The modulation of pain by attention and emotion : A dissociation of perceptual and spinal nociceptive processes. Eur J Pain 15 : 641e1-641e10 ; Godinho F, Magnin M, Frot M, Perchet C, Garcia-Larrea L (2006) Emotional modulation of pain : is it the sensation or what we recall ? J Neurosci, 26 :11454- 11461.
** Meunier A, Latrémolière A, Dominguez E, Mauborgne A, Mallet J, Phillipe S, Pohl M (2007) Lentiviral-mediated targeted NF-kB blockade in dorsal spinal cord glia attenuates sciatic nerve injury-induced hyperalgesia in rat. Mol Therapy, 15 : 687-697. Pour Revue voir : Scholz J, Woolf CJ (2007) The neuropathic pain triad: neurons, immune cells and glia. Nat Neurosci 10: 1361-1368.
*** Latrémolière A, Woolf CJ (2009) Central sensitization : a generator of pain hypersensitivity by central neural plasticity. J Pain, 10 : 895-926 ; McMahon SB, Jones NG (2004) Plasticity of pain signaling : role of neurotrophic factors exemplified by acid-induced pain. J Neurobiol, 61 : 72-87.
{AR-dmotion width= »500″ height= »500″}x28ds59{/AR-dmotion}