
Une nouvelle étude publiée sur le Journal of the American Medical Association
confirme que les personnes non vaccinées ont MOINS de symptômes quand elles contractent le Covid que celles ayant reçu deux ou trois doses. https://jamanetwork.com/journals/jama/
Le réseau HEROES-RECOVER
JAMA. 2022;328(15):1523-1533. doi:10.1001/jama.2022.18550
Points clés
Question Parmi une cohorte de travailleurs américains de première ligne et essentiels infectés par la souche d’origine ou les variantes Delta ou Omicron du SRAS-CoV-2, y a-t-il une différence dans les symptômes du COVID-19 ou la charge d’ARN viral parmi ceux qui reçoivent des vaccins à ARNm par rapport à ceux qui ne sont pas vaccinés ?
Résultats Dans cette étude de cohorte prospective qui comprenait 1199 participants infectés par le SRAS-CoV-2, la réception de 2 ou 3 doses de vaccin à ARNm avant les infections à Delta et de 3 doses de vaccin à ARNm avant les infections à Omicron était significativement associée à un COVID-19 plus léger (moins fréquemment symptomatique, fébrile, ou suivi médicalement ou durée de la maladie plus courte) par rapport au fait d’être non vacciné. La réception de 2 doses de vaccin à ARNm 14 à 149 jours avant l’infection par Delta ou Omicron était significativement associée à une charge d’ARN viral plus faible.
Signification Parmi une cohorte de travailleurs américains de première ligne et essentiels, la vaccination récente avec 2 ou 3 doses de vaccin à ARNm, par rapport à la non-vaccination, a été associée à des symptômes atténués du COVID-19 et à une charge d’ARN viral plus faible pour les variantes Delta et Omicron du SRAS-CoV-2 dans certaines comparaisons.
Résumé
Des données sur l’épidémiologie de la COVID-19 légère à modérément grave sont nécessaires pour éclairer les orientations de santé publique.
Objectif Évaluer les associations entre 2 ou 3 doses de vaccin ARNm COVID-19 et l’atténuation des symptômes et de la charge d’ARN viral dans les lignées virales SARS-CoV-2.
Conception, cadre et participants Une étude de cohorte prospective de travailleurs essentiels et de première ligne en Arizona, en Floride, au Minnesota, en Oregon, au Texas et en Utah avec une infection au COVID-19 confirmée par des tests de réaction en chaîne par transcriptase inverse-polymérase et une lignée classée par séquençage du génome entier de échantillons auto-prélevés chaque semaine et au début des symptômes de la maladie COVID-19. Cette analyse a été menée auprès de 1199 participants atteints du SRAS-CoV-2 du 14 décembre 2020 au 19 avril 2022, avec un suivi jusqu’au 9 mai 2022, rapporté.
Expositions Lignée SARS-CoV-2 (souche d’origine, variante Delta, variante Omicron) et statut vaccinal COVID-19.
Principaux résultats et mesures Les résultats cliniques comprenaient la présence de symptômes, des symptômes spécifiques (y compris de la fièvre ou des frissons), la durée de la maladie et la recherche de soins médicaux. Les résultats virologiques comprenaient la charge virale par test quantitatif de réaction en chaîne par transcriptase inverse-polymérase ainsi que la viabilité virale.
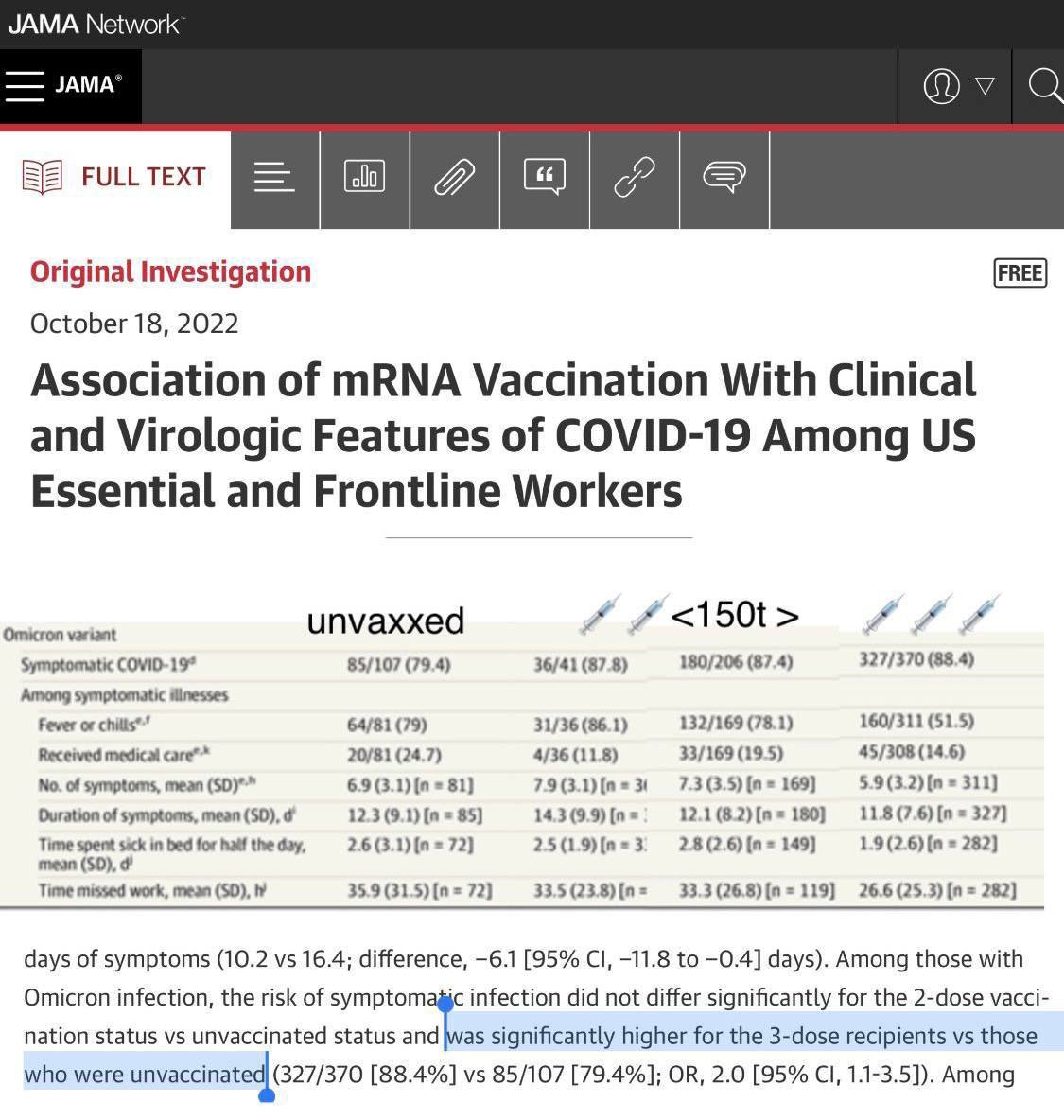
Résultats Parmi 1199 participants infectés par le COVID-19 (714 [59,5 %] femmes ; âge médian, 41 ans), 14,0 % étaient infectés par la souche d’origine, 24,0 % par la variante Delta et 62,0 % par la variante Omicron. Les participants vaccinés avec la deuxième dose de vaccin 14 à 149 jours avant l’infection Delta étaient significativement moins susceptibles d’être symptomatiques par rapport aux participants non vaccinés (21/27 [77,8 %] contre 74/77 [96,1 %] ; OR, 0,13 [IC à 95 %, 0-0,6]) et, lorsqu’elles étaient symptomatiques, les personnes vaccinées avec la troisième dose 7 à 149 jours avant l’infection étaient significativement moins susceptibles de signaler de la fièvre ou des frissons (5/13 [38,5 %] vs 62/73 [84,9 %] ; OR, 0,07 [IC à 95 %, 0,0-0,3]) et ont signalé significativement moins de jours de symptômes (10,2 contre 16,4 ; différence, -6,1 [IC à 95 %, -11,8 à -0,4] jours). Parmi les personnes infectées par Omicron, le risque d’infection symptomatique ne différait pas significativement pour le statut vacciné en 2 doses vs le statut non vacciné et était significativement plus élevé pour les receveurs de 3 doses vs ceux qui n’étaient pas vaccinés (327/370 [88,4%] vs 85/107 [79,4%] ; OR, 2,0 [IC à 95 %, 1,1-3,5]). Parmi les infections symptomatiques d’Omicron, les personnes vaccinées avec la troisième dose 7 à 149 jours avant l’infection par rapport à celles qui n’avaient pas été vaccinées étaient significativement moins susceptibles de signaler de la fièvre ou des frissons (160/311 [51,5 %] contre 64/81 [79,0 %] ; OU , 0,25 [IC à 95 %, 0,1-0,5]) ou consulter un médecin (45/308 [14,6 %] vs 20/81 [24,7 %] ; OR, 0,45 [IC à 95 %, 0,2-0,9]). Les participants atteints d’infections Delta et Omicron qui ont reçu la deuxième dose 14 à 149 jours avant l’infection avaient une charge virale moyenne significativement inférieure à celle des participants non vaccinés (3 vs 4,1 log ceux vaccinés avec la troisième dose 7 à 149 jours avant l’infection par rapport à ceux qui n’avaient pas été vaccinés étaient significativement moins susceptibles de signaler de la fièvre ou des frissons (160/311 [51,5 %] vs 64/81 [79,0 %] ; OR, 0,25 [95 % IC, 0,1-0,5]) ou consulter un médecin (45/308 [14,6 %] vs 20/81 [24,7 %] ; OR, 0,45 [IC 95 %, 0,2-0,9]). Les participants atteints d’infections Delta et Omicron qui ont reçu la deuxième dose 14 à 149 jours avant l’infection avaient une charge virale moyenne significativement inférieure à celle des participants non vaccinés (3 vs 4,1 log ceux vaccinés avec la troisième dose 7 à 149 jours avant l’infection par rapport à ceux qui n’avaient pas été vaccinés étaient significativement moins susceptibles de signaler de la fièvre ou des frissons (160/311 [51,5 %] vs 64/81 [79,0 %] ; OR, 0,25 [95 % IC, 0,1-0,5]) ou consulter un médecin (45/308 [14,6 %] vs 20/81 [24,7 %] ; OR, 0,45 [IC 95 %, 0,2-0,9]). Les participants atteints d’infections Delta et Omicron qui ont reçu la deuxième dose 14 à 149 jours avant l’infection avaient une charge virale moyenne significativement inférieure à celle des participants non vaccinés (3 vs 4,1 log10 copies/μL ; différence, -1,0 [IC à 95 %, -1,7 à -0,2] pour Delta et 2,8 vs 3,5 log 10 copies/μL, différence, -1,0 [IC à 95 %, -1,7 à -0,3] pour Omicron).
Conclusions et pertinence Dans une cohorte de travailleurs américains essentiels et de première ligne atteints d’infections par le SRAS-CoV-2, une vaccination récente avec 2 ou 3 doses de vaccin à ARNm moins de 150 jours avant l’infection par des variants Delta ou Omicron, par rapport au fait d’être non vacciné, a été associée à une les symptômes, la durée de la maladie, la recherche de soins médicaux ou la charge virale pour certaines comparaisons, bien que la précision et la signification statistique des estimations spécifiques aient varié.
Introduction
Il existe des données limitées sur l’épidémiologie des infections asymptomatiques par le SRAS-CoV-2 ou de la maladie COVID-19 légère à modérément grave, qui constituent la plupart des infections par le SRAS-CoV-2 et sont censées déclencher et alimenter les épidémies de SRAS-CoV-2. 1 – 4 Bien que les premiers rapports de cohortes communautaires prospectives aient observé que les vaccins COVID-19 atténuaient les symptômes, la durée et l’excrétion d’ARN viral du COVID-19, 5 – 8 résultats ont été mitigés dans des études récentes, 9 – 11 qui peuvent être dus au déclin de l’immunité associée au vaccin, 12 , 13 modifications des caractéristiques virologiques et évasion immunitaire accrue par les variantes Delta 14 et Omicron,15 ou une combinaison de facteurs. Les données sont également limitées à partir d’études qui effectuent des tests hebdomadaires de routine pour le SRAS-CoV-2 dans la communauté ou comparent plusieurs souches de SRAS-CoV-2 au sein de la même population.
Cette étude décrit une cohorte prospective de travailleurs essentiels et de première ligne dans 6 États américains infectés par le SRAS-CoV-2 identifiés par des tests de surveillance hebdomadaires, quels que soient les symptômes, et a 3 objectifs. Premièrement, l’étude a décrit le COVID-19 en caractérisant les caractéristiques cliniques et virologiques des infections avec les souches d’origine (origine), B.1.617.2 et toutes les lignées AY (Delta), et les lignées B.1.1.529 et BA1 (Omicron) et évaluer les associations entre les caractéristiques cliniques et la charge d’ARN viral. Deuxièmement, l’étude a évalué l’association des deuxième et troisième doses de vaccins à ARNm COVID-19 avec l’apparition d’une maladie symptomatique, de symptômes et d’une charge virale. Troisième,
Méthodes
Conception de l’étude et participants
Le réseau HEROES-RECOVER se compose de grandes cohortes prospectives de personnel de santé, de premiers intervenants et d’autres travailleurs essentiels et de première ligne, définis comme ceux qui travaillent au moins 20 heures par semaine dans une profession impliquant des contacts réguliers à moins de 3 pieds des autres, comme les travailleurs des secteurs suivants : éducation, agriculture, transformation des aliments, transport, collecte des déchets solides, services publics, services gouvernementaux, garde d’enfants, services environnementaux et hôtellerie. L’étude a été menée dans 6 États américains (Arizona, Floride, Minnesota, Oregon, Texas et Utah) avec des participants recrutés dans le cadre d’études de cohorte professionnelles en cours, de l’adhésion à une organisation de gestion de la santé et d’un emploi dans le système universitaire ou hospitalier en utilisant une approche d’inscription stratifiée en fonction de l’âge. et catégorie professionnelle (eMethods inSupplément 1 ). 16 , 17Tous les participants ont fourni un consentement éclairé écrit, et leurs protocoles et procédures communs ont été approuvés par les comités d’examen institutionnels des sites participants. Les données pour ces analyses ont été recueillies du 14 décembre 2020 (après autorisation des vaccins à ARNm) au 19 avril 2022, avec un suivi jusqu’au 9 mai 2022, rapporté. L’analyse a été menée parmi les participants qui ont été testés positifs pour le SRAS-CoV-2, à l’exclusion de ceux qui étaient infectés par le SRAS-CoV-2 avant la date de début de l’étude, infectés avant la fin d’une série de vaccins primaires à ARNm COVID-19 (<14 jours après dose 2), infecté soit moins de 7 jours, soit supérieur ou égal à 150 jours après la réception de la dose 3, ou qui a reçu le vaccin Ad26.COV2.S (Janssen/Johnson & Johnson) (eFigure 1 dans le Supplément 1 ).
Les participants ont rapporté des informations sociodémographiques, y compris la race et l’origine ethnique autodéclarées, les antécédents d’infection par le SRAS-CoV-2 et les conditions médicales chroniques (en utilisant une combinaison de catégories fixes et de texte ouvert). La race et l’origine ethnique ont été évaluées en raison de la possibilité d’une réception différentielle des vaccins selon la race et l’origine ethnique. Une surveillance active des symptômes associés à la COVID-19 (définis comme la présence d’au moins un des éléments suivants : fièvre, frissons, toux, essoufflement, mal de gorge, diarrhée, douleurs musculaires ou modification de l’odeur ou du goût) a été effectuée par SMS, e-mails et rapports hebdomadaires obtenus directement du participant.
Le statut de vaccination contre la COVID-19 a été signalé par les participants via des sondages en ligne et vérifié par le téléchargement direct d’images de cartes de vaccination sur tous les sites. De plus, les dossiers médicaux électroniques, les dossiers de santé au travail ou les registres de vaccination des États ont été examinés par le personnel des sites du Minnesota, de l’Oregon, du Texas et de l’Utah.
Essais en laboratoire
Les participants ont prélevé eux-mêmes des écouvillons nasaux du cornet moyen, quels que soient les symptômes, chaque semaine et au début des symptômes de la COVID-19. Les échantillons ont été expédiés sur des compresses froides et testés par un test qualitatif de réaction en chaîne par transcriptase inverse-polymérase (RT-PCR) au Marshfield Clinic Research Institute. La lignée virale a été déterminée par séquençage du génome entier 18 ou imputée comme le virus circulant prédominant (eMethods dans le supplément 1 ). Pour estimer l’excrétion virale, la charge d’ARN viral (ci-après dénommée charge virale ) a été évaluée par des tests RT-PCR quantitatifs effectués au Wisconsin State Laboratory of Hygiene.
Pour évaluer la viabilité du virus, les particules virales infectieuses ont été quantifiées par détermination des unités formant plaque (PFU) par millilitre sur des cellules Vero exprimant de manière ectopique TMPRSS3 et ACE2 19 humain au St Jude Children’s Research Hospital. Les monocouches de cellules infectées ont été colorées et les PFU ont été comptées visuellement. Les échantillons étaient éligibles pour l’évaluation de la PFU si le seuil du cycle RT-PCR était inférieur à 30, la lignée virale avait été confirmée et la charge virale était supérieure à 1 log 10 copies d’ARN/μL (eMethods dans le supplément 1 ). Les tentatives de culture de virus variants d’Omicron n’ont pas abouti.
Expositions
La lignée de l’infection par le SRAS-CoV-2 et le statut vaccinal étaient les principales expositions d’intérêt. La lignée virale a été classée comme origine (définie comme virus circulant avant les variantes reconnues), variante Delta ou variante Omicron. La date de l’indice d’infection a été définie comme la date d’apparition de la maladie ou la date de prélèvement de l’échantillon si asymptomatique. Le statut vaccinal a été classé en fonction des doses reçues par rapport à la date de l’indice d’infection : 2 doses reçues dans les 14 à 149 jours précédant l’infection, 2 doses reçues au moins 150 jours avant l’infection et 3 doses reçues dans les 7 à 149 jours précédant l’infection. Le groupe de comparaison n’était pas vacciné.
Résultats
Les résultats cliniques étaient la présence de COVID-19 symptomatique et, parmi les cas de COVID-19 symptomatique, le nombre de symptômes (0 à 19), la présence de fièvre ou de frissons, la durée de la maladie, le nombre de jours de maladie au lit pendant au moins la moitié de la journée , 20 heures de travail manquées pour cause de maladie et recherche de soins médicaux. Les résultats cliniques ont été autodéclarés via des sondages en ligne envoyés aux participants sur la déclaration des symptômes de la COVID-19. Des sondages en ligne supplémentaires ont été envoyés après 7 jours si les symptômes persistaient et sur la résolution de la maladie ; les participants asymptomatiques n’ont pas reçu d’enquêtes sur la maladie, mais ont confirmé l’absence de symptômes au moment où les résultats des tests RT-PCR ont été communiqués.
Les résultats virologiques étaient la charge virale et le nombre de PFU à partir d’échantillons auto-prélevés. Lorsque la charge virale était disponible à partir de plus d’un échantillon par infection, les analyses primaires se référaient à l’échantillon ayant la charge virale la plus élevée. La charge virale est rapportée comme la charge virale globale, la charge virale maximale, le temps jusqu’au pic et le temps jusqu’à ce que la charge soit inférieure à 1. La plage de charge virale était de 10 à 6 millions d’U/μL. La plage de PFU était de 20 à 11 000 U/mL. Les deux résultats ont été analysés et rapportés sous forme d’unités log 10 .
Analyses statistiques
Pour les résultats cliniques de la COVID-19, les rapports de cotes (RC) ont été estimés par régression logistique. Les différences moyennes pour les résultats cliniques et virologiques ont été estimées par régression linéaire. Tous les modèles ont été ajustés en fonction de la race, de l’origine ethnique et du nombre de médicaments sur ordonnance quotidiens pour une association potentielle avec le statut vaccinal et les résultats (eTableaux 3 et 4 dans le supplément 1). La profession a été incluse dans les modèles ajustés pour l’association entre la lignée virale et le travail manqué, mais n’a pas pu être incluse dans les modèles évaluant l’association entre le statut vaccinal et le travail manqué en raison de la colinéarité avec l’exposition au vaccin. Les analyses de la charge virale et du nombre de PFU ont été ajustées pour les jours entre les dates d’index et de collecte des échantillons. Les hypothèses du modèle, y compris la linéarité, la colinéarité et l’égalité de variance pour les modèles linéaires, ont été évaluées et respectées.
Semblable aux méthodes publiées précédemment, 21 la charge virale par jours depuis le début a été estimée à l’aide de modèles hiérarchiques linéaires bayésiens avec la lignée virale ou la présence d’une maladie symptomatique comme expositions. Temps écoulé depuis l’ajustement de la date d’index sous la forme d’une spline naturelle à 3 nœuds. Les modèles ont été ajustés parmi les participants avec au moins 3 échantillons RT-PCR positifs et au moins 1 échantillon avec une charge quantifiable. La charge virale a été prédite pour les échantillons positifs avec trop peu de virus à quantifier en utilisant la relation linéaire entre la valeur seuil qualitative du cycle RT-PCR et la charge virale. Une analyse de sensibilité a nécessité au moins 2 échantillons quantifiables (eMethods dans le Supplément 1 ). Les modèles ont convergé avec un R-hat inférieur à 1,05 et une taille d’échantillon effective supérieure à 100.
Les IC à 95 % bilatéraux pour les OR qui n’incluaient pas 1,0 et les différences moyennes qui n’incluaient pas 0 étaient considérés comme statistiquement significatifs. Toutes les analyses ont été réalisées avec le logiciel SAS, version 9.4 (SAS Institute) et le logiciel R, version 4.0.2 (R Foundation for Statistical Computing). En raison du potentiel d’erreur de type I dû aux comparaisons multiples, les résultats doivent être interprétés comme exploratoires.
Résultats
Caractéristiques de la cohorte
Sur 7223 participants inscrits à la surveillance active, 1710 ont été exclus en raison d’infections antérieures par le SRAS-CoV-2 ; sur les 5 513 participants restants, 997 (18,1 %) étaient des membres du personnel de soins de santé primaires (définis comme des médecins, des adjoints au médecin, des infirmières praticiennes et des dentistes), 1 785 (32,4 %) étaient des infirmières et d’autres professionnels paramédicaux, 1 218 (22,1 %) étaient des premiers intervenants et 1 513 (27,4 %) étaient d’autres travailleurs essentiels/de première ligne. Les participants ont rempli une médiane (IQR) de 90,5 % (78,1 % -97,0 %) de rapports de surveillance hebdomadaires et de collecte d’échantillons. Quatre-vingt-quinze pour cent des enquêtes sur la maladie ont été complétées, avec une fourchette de 94,0 % à 98,5 % d’achèvement dans les groupes de statut vaccinal. Au total, 1493 infections ont été identifiées par les tests RT-PCR. Après critères d’exclusion (eFigure 1 dans le Supplément 1), l’échantillon de l’étude était composé de 1 199 infections uniques confirmées par un test RT-PCR au cours de la période d’étude de 70 semaines ( tableau 1 ) ; il s’agissait de 14,0 % d’infections d’origine, 24,0 % Delta et 62,0 % d’infections Omicron. Parmi les 1199 participants infectés, l’âge médian (IQR) était de 41 (35,0-50,5) ans, 714 (59,5 %) étaient des femmes, 232 (19,3 %) étaient hispaniques, 22 (1,8 %) étaient asiatiques non hispaniques, 35 ( 2.9) étaient des Noirs non hispaniques et 871 (72,6%) étaient des Blancs non hispaniques (eTableau 2 du Supplément 1 ). Au moins 1 problème de santé chronique a été signalé pour 27,4 % des participants infectés et 27,7 % ont pris au moins 2 médicaments par jour. Les caractéristiques des participants non infectés non inclus dans cette étude sont présentées dans le tableau 1 .
Sur les 1199 participants infectés par le SRAS-CoV-2, 352 (29,4 %) n’étaient pas vaccinés, 72 (6,0 %) ont reçu la deuxième dose 14 à 149 jours avant l’infection, 374 (31,2 %) ont reçu la deuxième dose au moins 150 jours avant infection, et 401 (33,4 %) ont reçu la troisième dose 7 à 149 jours avant l’infection ( Tableau 2 ; eTableau 1 dans le Supplément 1 ). Parmi ceux qui ont reçu la troisième dose, 11 (2,7 %) étaient immunodéprimés par auto-déclaration ; la dose 3 a été considérée comme une primo-vaccination pour ces individus. Tous les participants ont reçu le même produit vaccinal pour la dose 1 et la dose 2 : 280 (62,3 %) ont reçu le BNT162b2 (Pfizer-BioNTech) et 166 (37,2 %) ont reçu les vaccins ARNm-1273 (Moderna). Pour la dose 3, un total de 22 des 401 personnes (5,5 %) ont reçu un produit vaccinal à ARNm différent de leur série primaire.
Caractéristiques cliniques du COVID-19 chez les participants non vaccinés
Pour décrire les caractéristiques cliniques de l’infection par chaque lignée virale, les 352 épisodes d’infection survenus chez les individus non vaccinés (parmi les 1199 épisodes d’infection au total) ont été examinés ( tableau 3); parmi ceux-ci, 44 (12,5 %) étaient asymptomatiques et 24 (6,8 %) présentaient des symptômes ne figurant pas dans la définition de cas de COVID-19. Les infections asymptomatiques étaient significativement plus fréquemment associées à Omicron qu’aux variants Delta (OR, 5,6 [IC 95 %, 1,6-19,6]). Lorsqu’ils étaient symptomatiques, 64,8 % des participants atteints de COVID-19 ont signalé de la fièvre ou des frissons ; le pourcentage était significativement plus élevé pour Delta par rapport à l’infection d’origine (84,9 % contre 71,8 % ; OR, 2,2 [IC à 95 %, 1,1-4,8]). La recherche de soins médicaux était significativement moins fréquente parmi les infections à Omicron (24,7 %) par rapport aux infections à Delta (47,3 %) (OR, 0,39 [IC à 95 %, 0,2-0,8]), mais n’était pas significativement différente entre Omicron et l’origine (36,9 %) infections (OR, 1,8 [IC à 95 %, (1,0-3,2)]).
Parmi les participants symptomatiques, les symptômes du COVID-19 associés à l’infection due à la variante Omicron ont duré en moyenne (ET) 12,3 (9,1) jours, soit 2,9 (IC à 95 %, -5,5 à -0,3) jours de moins que l’origine (moyenne de 15,6 jours) d’infection et 3,6 (IC à 95 %, -6,6 à -0,7) jours de moins que l’infection Delta (moyenne de 16,4 jours). Les participants infectés par Omicron ont passé en moyenne (ET) 2,6 (3,1) jours malades au lit, soit une moyenne de 1,2 (IC à 95 %, -2,5 à -0,0) jours de moins que ceux avec une infection d’origine et 2,0 (IC à 95 % , -3,4 à -0,6) jours de moins que ceux avec une infection Delta. D’autres résultats concernant les associations entre les caractéristiques cliniques et les caractéristiques des participants figurent dans le Tableau 3 et le eTableau 3 du Supplément 1 .
Comparaison des caractéristiques cliniques de Delta et d’Omicron selon le statut vaccinal
Les participants vaccinés et non vaccinés ont été examinés pour évaluer l’atténuation potentielle de la maladie associée au vaccin. Parmi les participants atteints d’infections Delta, la maladie était plus bénigne chez ceux qui avaient été vaccinés, bien que la précision de ces estimations variait ( tableau 2). Les participants qui ont reçu la deuxième dose 14 à 149 jours avant l’infection Delta par rapport à ceux qui n’ont pas été vaccinés étaient significativement moins susceptibles d’être symptomatiques (77,8 % contre 96,1 % ; OR, 0,13 [IC à 95 %, 0,0-0,6]) et ont passé beaucoup moins de jours malades au lit (2,3 vs 4,9 ; différence, -2,3 [IC à 95 %, -4,4 à -0,2] jours). Les participants symptomatiques qui ont reçu la dose 2 au moins 150 jours avant l’infection Delta par rapport à ceux qui n’ont pas été vaccinés étaient significativement moins susceptibles de signaler de la fièvre ou des frissons (70,4 % contre 84,9 % ; OR, 0,39 [IC à 95 %, 0,2-0,9]) ou consulter un médecin (31,5 % contre 47,3 % ; OR, 0,51 [IC à 95 %, 0,3-1,0]) et manquer beaucoup moins d’heures de travail (47,1 contre 62,8 ; différence, -15,2 [IC à 95 %, -26,4 à -4,1] heures).
Des différences significatives dans la présentation clinique entre les individus non vaccinés et ceux qui ont reçu 2 doses de vaccin n’ont pas été observées parmi les variantes d’infections d’Omicron. Cependant, les participants symptomatiques qui ont reçu la troisième dose de vaccin 7 à 149 jours avant l’infection par Omicron par rapport à ceux qui n’ont pas été vaccinés étaient significativement moins susceptibles de signaler de la fièvre ou des frissons (51,5 % contre 79,0 % ; OR, 0,25 [IC à 95 %, 0,1- 0,5]) ou reçoivent des soins médicaux (14,6 % vs 24,7 % ; OR, 0,45 [IC 95 %, 0,2-0,9]) et ont manqué significativement moins d’heures de travail (moyenne [ET] de 26,6 [25,3] vs 35,9 [31,5] ; différence, -11,1 [IC à 95 %, -18,4 à -3,9] heures), bien que les conseils sur l’isolement post-infection et le retour au travail aient changé au cours de la vague Omicron.
Charge virale
Pour 886 participants (73,8 %), l’échantillon avec la charge virale la plus élevée était leur premier échantillon positif collecté. La charge virale moyenne ne différait pas selon les caractéristiques démographiques (eTableau 4 du Supplément 1 ). Les infections symptomatiques par rapport aux infections asymptomatiques avaient une charge virale moyenne significativement plus élevée (différence moyenne, 1,3 log 10 copies/μL [IC à 95 %, 0,3-1,6] ; Figure 1 ) ; cette différence s’est produite systématiquement pour les infections Delta et Omicron (eTable 5 dans le Supplément 1 ). Pour toutes les lignées étudiées, la charge virale moyenne était significativement plus élevée pour les infections avec fièvre ou frissons (3,8 vs 3,4 log 10 copies/μL ; différence moyenne, 0,4 [IC à 95 %, 0,2-0,7]), celles avec 8 symptômes ou plus (3,9 vs 3.0 log 10; différence moyenne, 0,9 [IC 95 %, 0,6-1,3] log 10 copies/μL), et ceux dont les symptômes durent au moins 14 jours (4,0 vs 3,5 ; différence moyenne, 0,6 [IC 95 %, 0,3-0,9] log 10 copies /μL) ( Figure 1 et eTableau 5 dans le Supplément 1 ).
Les participants atteints d’infections Delta et Omicron qui ont reçu la deuxième dose de vaccin 14 à 149 jours avant l’infection avaient une charge virale moyenne significativement réduite par rapport aux participants non vaccinés (3 vs 4,1 log 10 copies/μL ; différence moyenne, -1,0 [IC à 95 %, – 1,7 à −0,2] log 10 copies/μL pour Delta ; 2,8 vs 3,5 log 10 copies/μL ; différence moyenne, −1,0 [IC à 95 %, −1,7 à −0,3] log 10 copies/μL pour Omicron) ( Figure 1 ) .
Pic et déclin de la charge virale
La charge virale au cours de l’infection a été estimée à l’aide d’un modèle hiérarchique bayésien parmi 407 participants vaccinés et non vaccinés qui ont fourni au moins 3 échantillons positifs pour le SRAS-CoV-2 (eTableau 6 dans le supplément 1 ). Le délai entre la détection du SRAS-CoV-2 et la charge virale maximale moyenne était de 2,5 jours pour les 3 lignées virales. La charge virale moyenne globale pour les infections d’origine et Delta était plus élevée que pour Omicron (différence moyenne, 0,2 [intervalle de crédibilité à 95 % (ICr), 0,0-0,4] log 10 copies/μL pour l’infection d’origine ; différence moyenne, 0,2 [ICr à 95 %, 0,1-0,5] log 10 copies/μL pour l’infection Delta) ( Figure 2UN). Pendant le pic estimé, la charge virale ne différait pas selon la lignée virale. Le temps estimé de déclin de la charge virale du pic à un nombre inférieur à 1 log 10 copies/μL était de 11 jours pour l’origine et l’infection Delta et de 10 jours pour l’infection Omicron ( Figure 2 A).
Dans toutes les lignées virales, la charge virale moyenne pour les infections asymptomatiques était inférieure à celle pour le COVID-19 symptomatique (différence moyenne, 0,7 [95 % CrI, 0,4-1,1] log 10 copies/μL) ( Figure 2 B). La charge virale maximale estimée était également plus faible pour les infections asymptomatiques (3,8 [95 % CrI, 3,4-4,2] log 10 copies/μL) que pour la COVID-19 symptomatique (4,5 [95 % CrI, 4,4-4,6] log 10 copies/μL) (eTableau 6 dans le Supplément 1 ). Le temps estimé entre la charge virale maximale et un nombre inférieur à 1 log 10 copies/μL était de 8 jours pour les infections asymptomatiques et de 10 jours pour le COVID-19 symptomatique ( Figure 2 B).
Nombre de SRAS-CoV-2 infectieux
Le nombre de particules virales viables n’a été examiné que pour les participants non vaccinés infectés par des virus d’origine et parmi les participants vaccinés et non vaccinés infectés par la variante Delta ( Figure 1 ). La PFU moyenne était significativement plus élevée pour les participants atteints de COVID-19 symptomatique que pour ceux souffrant d’infections asymptomatiques (4,2 contre 3 ; différence moyenne, 1,9 [IC à 95 %, 0,6-3,2] PFU/mL). La PFU moyenne était significativement plus faible chez les participants ayant reçu la dose 2 au moins 150 jours avant la percée d’infection ou la troisième dose 7 à 149 jours avant la percée d’infection par rapport aux participants non vaccinés (4,1 vs 4,8 ; différence moyenne, -0,8 [IC à 95 %, -1,5 à -0,1] PFU/mL et 3,1 vs 4,8 ; différence moyenne, -1,6 [IC à 95 %, -2,8 à -0,5] PFU/mL) ( Figure 1 ).
Discussion
Dans cette cohorte prospective de personnel de santé, premiers intervenants et autres travailleurs essentiels et de première ligne suivis du 14 décembre 2020 au 19 avril 2022, réception récente de 2 ou 3 doses de vaccin à ARNm COVID-19 14 à 149 jours avant à Delta ou Omicron BA.1 L’infection par le SRAS-CoV-2 était associée de manière variable à une présentation clinique plus bénigne, une durée de maladie plus courte, moins de recours aux soins médicaux et une charge virale plus faible, bien que la précision des estimations spécifiques variait.
Les différences observées entre les infections à Omicron et Delta dans les caractéristiques cliniques et virologiques peuvent aider à expliquer la transmissibilité accrue du variant Omicron signalée précédemment. 3 , 22 , 23 Les symptômes du COVID-19 associés à Omicron semblaient être plus légers et d’une durée plus courte que le COVID-19 associé à Delta selon de nombreux indicateurs. De plus, des symptômes plus légers qui ont duré moins de jours et une durée de maladie plus courte ont été associés à une plus faible perte d’ARN viral. Dans cette cohorte, 20,2 % des infections dues à Omicron étaient asymptomatiques, comme dans un autre rapport récent. 24En revanche, seulement 3,9 % des infections à Delta étaient asymptomatiques et étaient associées à une durée de maladie plus longue. Dans toutes les lignées virales de cette étude, les participants infectés sans symptômes ont éliminé l’ARN viral pendant environ 12 jours après le pic de charge virale par rapport aux participants symptomatiques présentant des symptômes, qui ont éliminé l’ARN viral pendant environ 18 jours. Au cours de la période de détection, la charge virale des infections à Omicron BA.1 était similaire à celle des infections Delta et supérieure à celle des infections avec les souches d’origine. Bien que l’excrétion d’ARN viral ne puisse pas être directement attribuable à la transmission, la charge virale relativement élevée des infections à Omicron ainsi que la fréquence plus élevée d’infection asymptomatique corroborent des études antérieures suggérant une association avec une transmission accrue, 21 , 25en particulier pendant les 3 à 5 premiers jours lorsque la charge virale a atteint son maximum.
Une étude de la cohorte HEROES-RECOVER a précédemment rapporté que les participants d’origine et d’autres infections par le virus pré-Delta (de décembre 2020 à avril 2021) après au moins 1 dose de vaccin ARNm COVID-19 avaient une charge virale plus faible, étaient moins susceptibles d’avoir symptômes fébriles et avaient des maladies plus courtes avec moins de jours passés malades au lit par rapport aux participants non vaccinés. 8De même, dans la présente étude, les percées d’infections associées à Delta 14 à 149 jours après la dose 2 avaient des charges virales inférieures à celles des participants non vaccinés ; en outre, les percées d’infection 14 à 149 jours après la dose 2 ou 7 à 149 jours après la dose 3 avaient des maladies plus courtes, avec un nombre inférieur de virus infectieux viables et présumés. Pour les infections à Omicron, seuls les participants présentant une percée d’infection après la dose 3 ont montré des signes cohérents d’atténuation vaccinale du COVID-19, comme être moins susceptibles d’avoir des symptômes fébriles ou de consulter un médecin. Il est possible que le rappel de la mémoire immunologique qui réduit la réplication virale et accélère l’élimination des cellules infectées par le virus qui peuvent sous-tendre l’atténuation vaccinale de la maladie 26 diminue avec le temps, comme la diminution des anticorps neutralisants27 et l’efficacité clinique des vaccins à ARNm. 12
Limites
Cette étude a plusieurs limites. Premièrement, bien qu’il s’agisse de l’une des plus grandes études de ce type avec des tests de surveillance de routine pour le SRAS-CoV-2, la stratification par lignée virale et expositions aux vaccins a abouti à des sous-groupes relativement petits, ce qui a réduit la précision des estimations. Deuxièmement, bien que plusieurs facteurs de confusion pertinents aient été contrôlés, une confusion non mesurée dans cette étude observationnelle aurait pu se produire. Les limites de la taille de l’échantillon et la capacité d’ajuster les modèles pour les facteurs de confusion potentiels ont rendu particulièrement difficile l’interprétation de résultats inattendus, tels qu’un pourcentage plus élevé d’individus présentant une maladie symptomatique parmi ceux vaccinés avec la troisième dose de vaccin 14 à 149 jours avant l’infection par Omicron par rapport à ceux qui n’étaient pas vaccinés. Troisième, les découvertes concernant les caractéristiques virologiques du COVID-19 se limitent au virus présent dans la cavité nasale, auto-collecté avec des écouvillons nasaux du cornet moyen. Par conséquent, les différences possibles entre les variants de l’ARN viral présents dans le nasopharynx complet ou le système respiratoire inférieur n’ont pas pu être examinées. Quatrièmement, en raison d’obstacles méthodologiques liés à la culture de virus variants d’Omicron, la viabilité du virus n’a pu être examinée qu’avec les virus d’origine et Delta. Cinquièmement, la détection de l’ARN viral et l’isolement du virus viable par culture virale ne sont pas des mesures directes de la transmissibilité du virus, bien que des preuves émergent pour le SRAS-CoV-2 en raison d’obstacles méthodologiques liés à la culture de virus variants d’Omicron, la viabilité du virus n’a pu être examinée qu’avec les virus d’origine et Delta. Cinquièmement, la détection de l’ARN viral et l’isolement du virus viable par culture virale ne sont pas des mesures directes de la transmissibilité du virus, bien que des preuves émergent pour le SRAS-CoV-2 en raison d’obstacles méthodologiques liés à la culture de virus variants d’Omicron, la viabilité du virus n’a pu être examinée qu’avec les virus d’origine et Delta. Cinquièmement, la détection de l’ARN viral et l’isolement du virus viable par culture virale ne sont pas des mesures directes de la transmissibilité du virus, bien que des preuves émergent pour le SRAS-CoV-225 et les deux sont associés à la transmission d’autres infections virales. 28 – 30 Sixièmement, les résultats sur les heures de travail manquées doivent être interprétés avec prudence car les directives sur l’isolement post-infection et le retour au travail ont changé au fil du temps et les protocoles d’isolement liés au travail n’ont pas été pris en compte. Septièmement, les symptômes signalés par les participants et la durée de la maladie peuvent être sujets à des biais de rappel et de confirmation. Huitièmement, ces résultats peuvent ne pas être généralisés à toute la population des États-Unis, en particulier compte tenu du pourcentage relativement faible de participants qui n’étaient pas blancs.
conclusion
Dans une cohorte de travailleurs essentiels et de première ligne aux États-Unis atteints d’infections par le SRAS-CoV-2, une vaccination récente avec 2 ou 3 doses de vaccin à ARNm moins de 150 jours avant l’infection par des variants Delta ou Omicron, par rapport au fait d’être non vacciné, a été associée à des symptômes atténués, à la durée de la maladie, de la recherche de soins médicaux et de la charge virale pour certaines comparaisons, même si la précision et la signification statistique des estimations spécifiques variaient.
Informations sur l’article
Auteur correspondant : Ashley L. Fowlkes, ScD, MPH, Influenza Division, Centers for Disease Control and Prevention, 1600 Clifton Rd, Atlanta, GA 30333 ( ahl4@cdc.gov ).
Accepté pour publication : 20 septembre 2022.
HEROES-RECOVER Auteurs :Mark G. Thompson, Ph.D. ; Sarang K. Yoon, DO, ministère de la Santé ; Allison L. Naleway, Ph.D. ; Jennifer Meece, PhD; Thomas P. Fabrice, PhD; Alberto J. Caban-Martinez, DO, PhD, MPH ; Jefferey L. Burgess, MD, MS, MPH ; Manjusha Gaglani, MBBS ; Lauren EW Olsho, PhD; Allen Bateman, Ph.D. ; Jessica Lundgren, inf., B.S.N. ; Lauren Grant, MS ; Andrew L. Phillips, MD, MOH ; Holly C. Groom, MPH; Elisha Stefanski, BS; Natasha Schaefer Solle, Ph. D., inf. Katherine Ellingson, PhD; Karen Lutrick, Ph.D. ; Kayan Dunnigan, MPH ; Meredith G. Wesley, MPH ; Kyley Guenther, BS; Angela Hunt, MLT, ASCP ; Joséphine Mak, MPH ; Kurt T. Hegmann, MD, MPH ; Jennifer L. Kuntz, Ph.D. ; Adam Bissonnette, MS; James Hollister, MS ; Spencer Rose, BS; Tyler C. Morrill, MS ; Karley Respet, BS; Ashley L. Fowlkes, ScD, MPH ; Matthew S. Thiese, Ph.D., MSPH ; Patrick Rivers, député provincial; Meghan K. Herring, MPH ; Marilyn J. Odean, MS ; Jeune M. Yoo, MSPH ; Matthew Brunner, BS; Edward J. Bedrick, PhD; Deanna E. Fleary, MsC; John T. Jones, MSPH ; Jenna Praggastis, BS; James Romine, Ph.D., MPH ; Monica Dickerson, BS; Sana M. Khan, MPH ; Julie Mayo Lamberte, MSPH; Shawn Beitel, MSc; Richard J. Webby, PhD; Harmony L. Tyner, MD.
Affiliations des auteurs de HEROES-RECOVER :Centers for Disease Control and Prevention COVID-19 Response Team, Atlanta, Géorgie (Thompson, Grant, Mak, Fowlkes, Yoo, Jones, Dickerson, Lamberte); Rocky Mountain Center for Occupational and Environmental Health, Department of Family and Preventive Medicine, University of Utah Health, Salt Lake City, Utah (Yoon, Phillips, Hegmann, Thiese, Brunner, Praggastis); Kaiser Permanente Northwest Center for Health Research, Portland, Oregon (Naleway, Groom, Kuntz); Institut de recherche de la clinique Marshfield, Marshfield, Wisconsin (Meece, Stefanski, Bissonnette); Hôpital de recherche pour enfants St Jude, Memphis, Tennessee (Fabrizio, Webby); École de médecine Leonard M. Miller, Université de Miami, Miami, Floride (Caban-Martinez, Solle); Mel et Enid Zuckerman College of Public Health, Université d’Arizona, Tucson, Arizona (Burgess, Ellingson, Hollister, Bedrick, Romine, Khan, Beitel); Baylor Scott et White Health, Temple, Texas (Gaglani, Dunnigan, Rose); Collège de médecine de l’Université Texas A&M, Temple (Gaglani); Abt Associates Inc, Rockville, Maryland (Olsho, Wesley, Morrill, Herring, Fleary); Laboratoire d’hygiène de l’État du Wisconsin, Madison (Bateman, Guenther); Système de santé régional de St Luke, Duluth, Minnesota (Lundgren, Hunt, Respet, Tyner); Collège de médecine – Tucson, Université de l’Arizona, Tucson (Lutrick, Rivers); Institut Whiteside pour la recherche clinique, St Luke’s, Duluth, Minnesota (Odean). Madison (Bateman, Guenther); Système de santé régional de St Luke, Duluth, Minnesota (Lundgren, Hunt, Respet, Tyner); Collège de médecine – Tucson, Université de l’Arizona, Tucson (Lutrick, Rivers); Institut Whiteside pour la recherche clinique, St Luke’s, Duluth, Minnesota (Odean). Madison (Bateman, Guenther); Système de santé régional de St Luke, Duluth, Minnesota (Lundgren, Hunt, Respet, Tyner); Collège de médecine – Tucson, Université de l’Arizona, Tucson (Lutrick, Rivers); Institut Whiteside pour la recherche clinique, St Luke’s, Duluth, Minnesota (Odean).
Contributions des auteurs : les Drs Thompson et Mme Grant ont eu un accès complet à toutes les données de l’étude et assument la responsabilité de l’intégrité des données et de l’exactitude de l’analyse des données.
Concept et design : Thompson, Yoon, Naleway, Meece, Fabrizio, Caban-Martinez, Burgess, Gaglani, Olsho, Grant, Phillips, Mak, Hegmann, Lutrick, Hunt, Fowlkes, Thiese, Herring, Respet, Bruner, Mayo Lamberte, Beitel , Webby, Tyner.
Acquisition, analyse ou interprétation des données : tous les auteurs.
Rédaction du manuscrit : Thompson, Yoon, Caban-Martinez, Burgess, Grant, Lundgren, Fowlkes, Thiese, Jones, Dickerson, Mayo Lamberte.
Révision critique du manuscrit pour un contenu intellectuel important : Thompson, Yoon, Naleway, Meece, Fabrizio, Caban-Martinez, Burgess, Gaglani, Olsho, Grant, Phillips, Groom, Bateman, Stefanski, Schaefer Solle, Ellingson, Dunnigan, Wesley, Mak , Hegmann, Kuntz, Guenther, Bissonnette, Lutrick, Rose, Morrill, Hunt, Fowlkes, Thiese, Hollister, Hareng, Respet, Yoo, Bruner, Rivières, Fleary, Odean, Praggastis, Bedrick, Romine, Khan, Beitel, Webby, Tyner .
Analyse statistique : Thompson, Grant, Mak, Thiese, Yoo, Jones, Bedrick.
Financement obtenu : Thompson, Yoon, Burgess, Olsho, Thiese.
Soutien administratif, technique ou matériel : Thompson, Yoon, Naleway, Meece, Fabrizio, Caban-Martinez, Burgess, Gaglani, Olsho, Phillips, Groom, Bateman, Stefanski, Schaefer Solle, Ellingson, Wesley, Lundgren, Hegmann, Kuntz, Bissonnette , Lutrick, Morrill, Hunt, Fowlkes, Thiese, Hollister, Herring, Respet, Bruner, Rivers, Fleary, Praggastis, Dickerson, Mayo Lamberte, Khan, Beitel, Webby, Tyner.
Encadrement : Thompson, Yoon, Meece, Olsho, Lundgren, Hegmann, Kuntz, Bissonnette, Thiese, Bruner, Praggastis, Webby.
Divulgations de conflits d’intérêts :Le Dr Naleway a déclaré avoir reçu des fonds de recherche de Pfizer et Vir Biotechnology en dehors du travail soumis. Les Drs Webby et Fabrizio sont financés par l’Institut national des allergies et des maladies infectieuses, les Instituts nationaux de la santé (numéro de subvention HHSN2272201400006C) et l’ALSAC. Le Dr Gaglani a déclaré avoir reçu des subventions de Janssen et Pfizer et avoir été coprésident du comité des maladies infectieuses et de la vaccination de la Texas Pediatric Society, chapitre du Texas de l’American Academy of Pediatrics. Le Dr Hegmann a déclaré avoir reçu des honoraires personnels de l’American College of Occupational and Environmental Medicine / Reed Group pour son travail en tant qu’éditeur de lignes directrices révisées par des pairs, y compris les lignes directrices COVID-19, en dehors du travail soumis. Le Dr Kuntz a déclaré avoir reçu une subvention de recherche pour l’institution de Vir Biotechnology, Pfizer, et Novartis en dehors du travail soumis. Aucune autre divulgation n’a été signalée.
Financement/Soutien : Le financement a été fourni en tout ou en partie par des fonds fédéraux du Centre national pour l’immunisation et les maladies respiratoires, Centres pour le contrôle et la prévention des maladies (CDC), sous les numéros de contrat 75D30120R68013 attribués au Marshfield Clinic Research Laboratory, 75D30120C08379 à l’Université de Arizona et 75D30120C08150 attribués à Abt Associates, Inc.
Rôle du bailleur de fonds/sponsor : Le CDC a été impliqué dans la conception et la conduite de l’étude ; collecte, gestion, analyse et interprétation des données ; préparation, révision et approbation du manuscrit ; et décision de soumettre le manuscrit pour publication.
Avis de non-responsabilité : les résultats et les conclusions de ce rapport sont ceux des auteurs et ne représentent pas nécessairement la position officielle des Centers for Disease Control and Prevention.
Déclaration de partage de données : les données seront disponibles par le CDC lorsque les objectifs de la recherche seront atteints.
Informations supplémentaires : Le réseau HEROES-RECOVER comprend Arizona Healthcare, Emergency Response and Other Essential Workers Surveillance Study (HEROES) et Research on the Epidemiology of SARS-CoV-2 in Essential Response Personnel (RECOVER).
Références
1.
Meyerowitz EA, Richterman A, Bogoch II, Low N, Cevik M. Vers une caractérisation précise et systématique de l’infection asymptomatique persistante par le SRAS-CoV-2. Lancet Infect Dis . 2021;21(6):e163-e169. doi : 10.1016/S1473-3099(20)30837-9PubMedGoogle ScholarRéférence croisée
2.
Li R, Pei S, Chen B, et al. Une infection substantielle non documentée facilite la diffusion rapide du nouveau coronavirus (SARS-CoV-2). Sciences . 2020;368(6490):489-493. doi: 10.1126/science.abb3221PubMedGoogle ScholarRéférence croisée
3.
Iuliano AD, Brunkard JM, Boehmer TK, et al. Tendances de la gravité de la maladie et de l’utilisation des soins de santé au cours de la première période de la variante omicron par rapport aux périodes de transmission élevée précédentes du SRAS-CoV-2 : États-Unis, décembre 2020-janvier 2022. MMWR Morb Mortal Wkly Rep . 2022;71(4):146-152. doi : 10.15585/mmwr.mm7104e4PubMedGoogle ScholarRéférence croisée
4.
Lipsitch M, Krammer F, Regev-Yochay G, Lustig Y, Balicer RD. Percées d’infections par le SRAS-CoV-2 chez les personnes vaccinées : mesure, causes et impact. Nat Rev Immunol . 2022;22(1):57-65. doi : 10.1038/s41577-021-00662-4PubMedGoogle ScholarRéférence croisée
5.
Strum E, Casagrande Y, Newton K, Unger JB. Les travailleurs de la santé bénéficient d’une deuxième dose de vaccin à ARNm COVID-19 : effets de la vaccination partielle et complète sur la durée des congés de maladie et les symptômes. Pratique de santé publique . 2022;3:100247. doi : 10.1016/j.puhip.2022.100247PubMedGoogle ScholarRéférence croisée
6.
Sadoff J, Gray G, Vandebosch A, et al ; Groupe d’étude ENSEMBLE. Innocuité et efficacité du vaccin Ad26.COV2.S à dose unique contre le Covid-19. N Engl J Med . 2021;384(23):2187-2201. doi : 10.1056/NEJMoa2101544PubMedGoogle ScholarRéférence croisée
sept.
Regev-Yochay G, Amit S, Bergwerk M, et al. Diminution de l’infectivité suite à la vaccination par le BNT162b2 : une étude de cohorte prospective en Israël. Lancet Reg Health Eur . 2021;7:100150. doi : 10.1016/j.lanepe.2021.100150PubMedGoogle ScholarRéférence croisée
8.
Thompson MG, Burgess JL, Naleway AL, et al. Prévention et atténuation du Covid-19 avec les vaccins BNT162b2 et mRNA-1273. N Engl J Med . 2021;385(4):320-329. doi : 10.1056/NEJMoa2107058PubMedGoogle ScholarRéférence croisée
9.
Brown CM, Vostok J, Johnson H, et al. Éclosion d’infections par le SRAS-CoV-2, y compris les infections par percée du vaccin COVID-19, associées à de grands rassemblements publics : comté de Barnstable, Massachusetts, juillet 2021. MMWR Morb Mortal Wkly Rep . 2021;70(31):1059-1062. doi : 10.15585/mmwr.mm7031e2PubMedGoogle ScholarRéférence croisée
dix.
Riemersma KK, Grogan BE, Kita-Yarbro A, et al. Excrétion du SRAS-CoV-2 infectieux malgré la vaccination. medRxiv . 2021;doi : 10.1101/2021.07.31.21261387Google Scholar
11.
Puhach O, Adea K, Hulo N, et al. Charge virale infectieuse chez les patients non vaccinés et vaccinés infectés par le SARS-CoV-2 WT, Delta et Omicron. medRxiv . 2022;doi : 10.1101/2022.01.10.22269010Google Scholar
12.
Ferdinands JM, Rao S, Dixon BE, et al. Efficacité décroissante à 2 et 3 doses des vaccins à ARNm contre les visites aux urgences et les soins d’urgence associés au COVID-19 et les hospitalisations chez les adultes pendant les périodes de prédominance des variantes Delta et Omicron : Réseau VISION, 10 États, août 2021-janvier 2022. MMWR Morb Mortal Wkly Rep . 2022;71(7):255-263. doi : 10.15585/mmwr.mm7107e2PubMedGoogle ScholarRéférence croisée
13.
Chemaitelly H, Tang P, Hasan MR, et al. Déclin de la protection du vaccin BNT162b2 contre l’infection par le SRAS-CoV-2 au Qatar. N Engl J Med . 2021;385(24):e83. doi : 10.1056/NEJMoa2114114PubMedGoogle ScholarRéférence croisée
14.
Wall EC, Wu M, Harvey R, et al. Neutralisation de l’activité des anticorps contre les COV SARS-CoV-2 B.1.617.2 et B.1.351 par vaccination BNT162b2. Lancette . 2021;397(10292):2331-2333. doi : 10.1016/S0140-6736(21)01290-3PubMedGoogle ScholarRéférence croisée
15.
Dejnirattisai W, Huo J, Zhou D, et al ; Consortium OPTIQUE ; Consortium ISARIC4C. Le SRAS-CoV-2 Omicron-B.1.1.529 conduit à une fuite généralisée des réponses d’anticorps neutralisants. Cellule . 2022;185(3):467-484.e15. doi : 10.1016/j.cell.2021.12.046PubMedGoogle ScholarRéférence croisée
16.
Edwards LJ, Fowlkes AL, Wesley MG, et al. Recherche sur l’épidémiologie du SRAS-CoV-2 chez le personnel d’intervention essentiel (RECOVER): protocole pour une étude de cohorte longitudinale multisite. Protocole de résolution JMIR . 2021;10(12):e31574. doi : 10.2196/31574PubMedGoogle ScholarRéférence croisée
17.
Lutrick K, Ellingson KD, Baccam Z, et al. Infection au COVID-19, réinfection et efficacité du vaccin dans une cohorte prospective de travailleurs de première ligne/essentiels en Arizona : le protocole de recherche AZ HEROES. Protocole de résolution JMIR . 2021. doi : 10.2196/28925PubMedGoogle ScholarRéférence croisée
18.
Paden CR, Tao Y, Queen K, et al. Séquençage rapide, sensible et complet du génome du coronavirus 2 du syndrome respiratoire aigu sévère. Emerg Infect Dis . 2020;26(10):2401-2405. doi : 10.3201/eid2610.201800PubMedGoogle ScholarRéférence croisée
19.
Matsuyama S, Nao N, Shirato K, et al. Isolement amélioré du SRAS-CoV-2 par les cellules exprimant TMPRSS2. Proc Natl Acad Sci États-Unis . 2020;117(13):7001-7003. doi : 10.1073/pnas.2002589117PubMedGoogle ScholarRéférence croisée
20.
Searle SD, Mitnitski A, Gahbauer EA, Gill TM, Rockwood K. Une procédure standard pour créer un indice de fragilité. BMC Gériatrie . 2008;8:24. doi : 10.1186/1471-2318-8-24PubMedGoogle ScholarRéférence croisée
21.
Jones TC, Biele G, Mühlemann B, et al. Estimation de l’infectiosité tout au long de l’évolution de l’infection par le SRAS-CoV-2. Sciences . 2021;373(6551):eabi5273. doi : 10.1126/science.abi5273PubMedGoogle ScholarRéférence croisée
22.
Ito K, Piantham C, Nishiura H. Nombre de reproduction instantanée relative de la variante Omicron SARS-CoV-2 par rapport à la variante Delta au Danemark. J Med Virol . 2022;94(5):2265-2268. doi : 10.1002/jmv.27560PubMedGoogle ScholarRéférence croisée
23.
Hay JA, Kissler SM, Fauver JR, et al. Dynamique virale et durée de positivité PCR du variant SARS-CoV-2 Omicron. medRxiv . 2022;doi : 10.1101/2022.01.13.22269257Google Scholar
24.
Garrett N, Tapley A, Andriesen J, et al ; Équipe d’étude d’Ubuntu. Portage asymptomatique élevé avec la variante Omicron en Afrique du Sud. Clin Infect Dis . 2022;75(1):e289-e292. doi : 10.1093/cid/ciac237PubMedGoogle ScholarRéférence croisée
25.
Marques M, Millat-Martinez P, Ouchi D, et al. Transmission de COVID-19 dans 282 clusters en Catalogne, Espagne : une étude de cohorte. Lancet Infect Dis . 2021;21(5):629-636. doi : 10.1016/S1473-3099(20)30985-3PubMedGoogle ScholarRéférence croisée
26.
Ferdinands JM, Thompson MG, Blanton L, Spencer S, Grant L, Fry AM. La vaccination antigrippale atténue-t-elle la gravité des percées infectieuses ? un examen narratif et des recommandations pour des recherches futures. Vaccin . 2021;39(28):3678-3695. doi: 10.1016/j.vaccine.2021.05.011PubMedGoogle ScholarRéférence croisée
27.
Falsey AR, Frenck RW Jr, Walsh EE, et al. Neutralisation du SRAS-CoV-2 avec la dose 3 du vaccin BNT162b2. N Engl J Med . 2021;385(17):1627-1629. doi : 10.1056/NEJMc2113468PubMedGoogle ScholarRéférence croisée
28.
Anand BS, Vélez M. Évaluation de la corrélation entre les titres sériques du virus de l’hépatite C et la gravité de la maladie hépatique. Monde J Gastroentérol . 2004;10(16):2409-2411. doi : 10.3748/wjg.v10.i16.2409PubMedGoogle ScholarRéférence croisée
29.
MacDonald M, Crofts N, Kaldor J. Transmission du virus de l’hépatite C : taux, voies et cofacteurs. Epidemiol Rev. 1996;18(2):137-148. doi : 10.1093/oxfordjournals.epirev.a017921PubMedGoogle ScholarRéférence croisée
30.
Tsang TK, Cowling BJ, Fang VJ, et al. Excrétion et infectiosité du virus de la grippe A dans les ménages. J Infect Dis . 2015;212(9):1420-1428. doi : 10.1093/infdis/jiv225PubMedGoogle ScholarRéférence croisée