Tocilizumab pour le traitement des patients sous ventilation mécanique atteints de COVID-19
Emilie C Somers 1 2 3, Grégoire A Eschenauer 4, Jonathan P Troost 5, Jonathan L Golob 1, Tejal N Gandhi 1, Lu Wang 6, Nina Zhou 6, Lindsay un petit 1, Ji Hoon Baang 1, Nicolas O Dillman 7, David Cadre 4, Kevin S Gregg 1, Dan R Kaul 1, Jérôme Nagel 7, Twisha S Patel 7, Shiwei Zhou 1, Adam S Lauring 1, David A Hanauer 8, Emilie Martin 9, Pratima Sharma 1, Christophe M Fung dix, Jason M Pogue 4
Affiliations développer
PMID : 32651997
PMCID : PMC7454462
DOI : 10.1093/cid/ciaa954
Article PMC gratuit
Abstrait
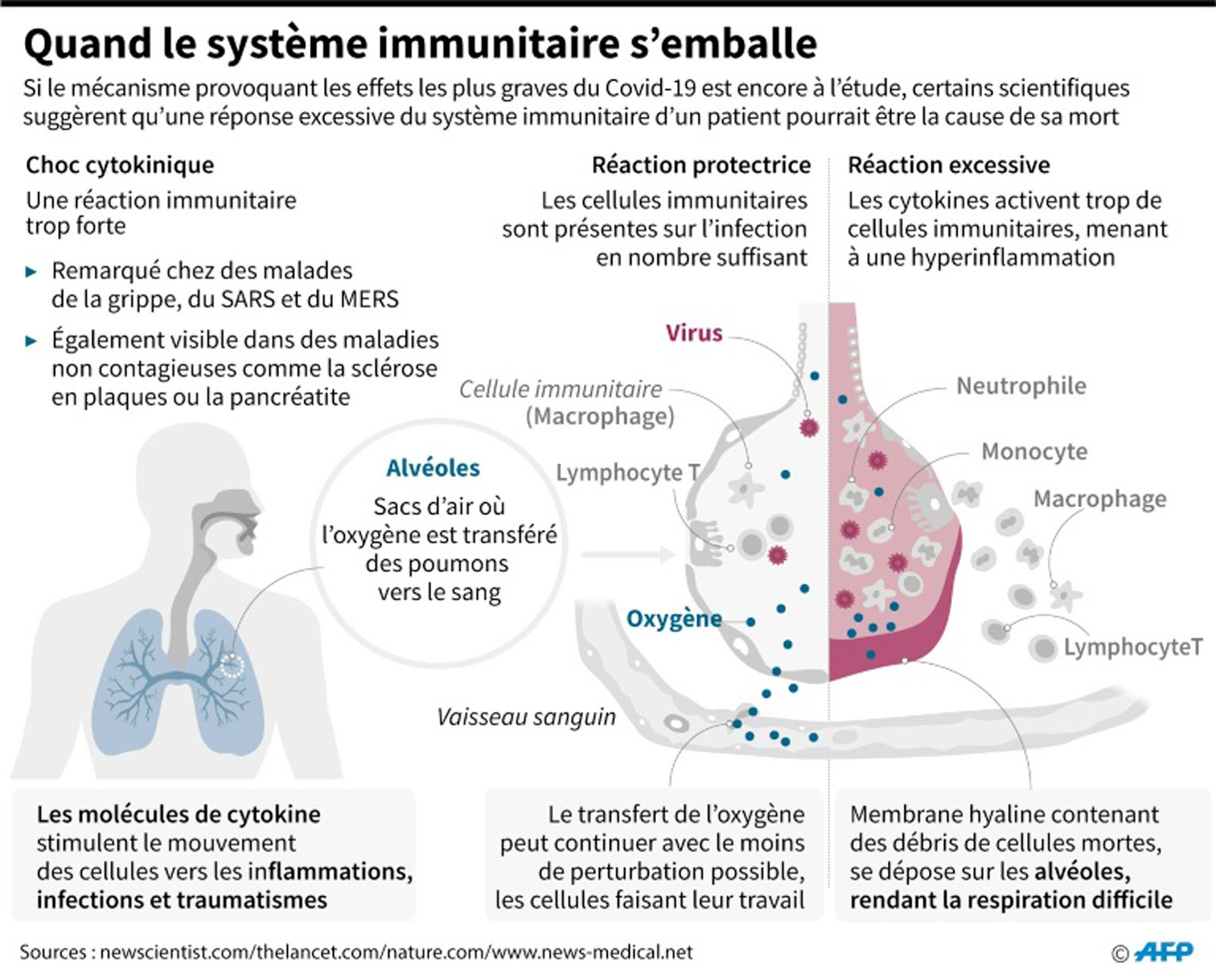
Contexte : La maladie à coronavirus sévère 2019 (COVID-19) peut se manifester par une décompensation rapide et une insuffisance respiratoire avec des marqueurs inflammatoires élevés, compatibles avec le syndrome de libération de cytokines pour lequel le blocage de l’IL-6 est un traitement approuvé.
Méthodes : Nous avons évalué l’efficacité et l’innocuité du blocage de l’IL-6 avec le tocilizumab dans une cohorte monocentrique de patients atteints de COVID-19 nécessitant une ventilation mécanique. Le critère d’évaluation principal était la probabilité de survie après l’intubation ; les analyses secondaires comprenaient une échelle de gravité de la maladie ordinale intégrant les surinfections. Les résultats chez les patients ayant reçu du tocilizumab par rapport aux témoins non traités par le tocilizumab ont été évalués à l’aide d’une régression de Cox multivariable avec un score de propension à probabilité inverse de pondération du traitement (IPTW).
Résultats: 154 patients ont été inclus, dont 78 ont reçu du tocilizumab et 76 n’en ont pas reçu. Le suivi médian était de 47 jours (extrêmes, 28-67). Les caractéristiques de base étaient similaires entre les groupes, bien que les patients traités par le tocilizumab étaient plus jeunes (moyenne : 55 ans contre 60 ans), moins susceptibles de souffrir d’une maladie pulmonaire chronique (10 % contre 28 %) et avaient des valeurs de D-dimères plus faibles au moment de l’intubation ( médiane : 2,4 vs 6,5 mg/dL). Dans les modèles ajustés selon l’IPTW, le tocilizumab était associé à une réduction de 45 % du risque de décès (RR : 0,55 ; IC à 95 % : 0,33 à 0,90) et à une amélioration de l’état sur l’échelle de résultats ordinale [OR par augmentation de 1 niveau, .58 ; .36-.94). Bien que le tocilizumab ait été associé à une proportion accrue de patients présentant des surinfections (54 % contre 26 % ; P < 0,001), il n’y avait aucune différence dans le taux de létalité à 28 jours entre les patients traités par tocilizumab avec ou sans surinfection (22 % contre 15 % ; P = 0,42). Staphylococcus aureus représentait environ 50 % des pneumonies bactériennes.
Conclusions : Dans cette cohorte de patients COVID-19 ventilés mécaniquement, le tocilizumab était associé à une mortalité plus faible malgré une fréquence de surinfection plus élevée.
Mots – clés : COVID-19 ; SRAS-CoV-2; interleukine-6; tocilizumab.
© The Author(s) 2020. Publié par Oxford University Press pour l’Infectious Diseases Society of America.
Mise à jour de
Tocilizumab pour le traitement des patients sous ventilation mécanique atteints de COVID-19.
Somers EC, Eschenauer GA, Troost JP, Golob JL, Gandhi TN, Wang L, Zhou N, Petty LA, Baang JH, Dillman NO, Frame D, Gregg KS, Kaul DR, Nagel J, Patel TS, Zhou S, Lauring AS , Hanauer DA, Martin E, Sharma P, Fung CM, Pogue JM.medRxiv. 3 juin 2020 2020.05.29.20117358. doi: 10.1101/2020.05.29.20117358. Préimpression.PMID : 32577684 Article PMC gratuit. Actualisé.
Commenter dans
Toci ou pas toci pour la maladie à coronavirus 2019 (COVID-19) : est-ce toujours la question ?
Cheng GS, Hill JA.Clin Infect Dis. 15 juillet 2021 ; 73(2) : e455-e457. doi: 10.1093/cid/ciaa1133.PMID : 32735642 Article PMC gratuit. Aucun résumé disponible.
Articles similaires
Tocilizumab pour le traitement des patients sous ventilation mécanique atteints de COVID-19.
Somers EC, Eschenauer GA, Troost JP, Golob JL, Gandhi TN, Wang L, Zhou N, Petty LA, Baang JH, Dillman NO, Frame D, Gregg KS, Kaul DR, Nagel J, Patel TS, Zhou S, Lauring AS , Hanauer DA, Martin E, Sharma P, Fung CM, Pogue JM.medRxiv. 3 juin 2020 2020.05.29.20117358. doi: 10.1101/2020.05.29.20117358. Préimpression.PMID : 32577684 Article PMC gratuit. Actualisé.
Emadi A, Chua JV, Talwani R, Bentzen SM, Baddley J.Essais. 28 octobre 2020;21(1):897. doi: 10.1186/s13063-020-04819-9.PMID : 33115543 Article PMC gratuit.
Gupta S, Wang W, Hayek SS, Chan L, Mathews KS, Melamed ML, Brenner SK, Leonberg-Yoo A, Schenck EJ, Radbel J, Reiser J, Bansal A, Srivastava A, Zhou Y, Finkel D, Green A, Mallappallil M, Faugno AJ, Zhang J, Velez JCQ, Shaefi S, Parikh CR, Charytan DM, Athavale AM, Friedman AN, Redfern RE, Short SAP, Correa S, Pokharel KK, Admon AJ, Donnelly JP, Gershengorn HB, Douin DJ , Semler MW, Hernán MA, Leaf DE; Enquêteurs STOP-COVID.Stagiaire JAMA Med. 1er janvier 2021;181(1):41-51. doi: 10.1001/jamainternmed.2020.6252.PMID : 33080002
Kulanthaivel S, Kaliberdenko VB, Balasundaram K, Shterenshis MV, Scarpelini E, Abenavoli L.Rev Récents Essais Clin. 2021;16(2):138-145. doi: 10.2174/1574887115666200917110954.PMID : 32940187 Revoir.
Luis BM, Miguel MB, Pedro DL, David IP, Itziar A, Ana GH, Enrique IJ, María LV, Noelia TF, Julio César BB, Marta UI, Rodrigo SL, María CB, Andrés LM, Javier MI, Juan Pablo GM, Gerardo HF, Carolina NF, Jorge BL, María FR, Fernando CT, Sergio OE, Lourdes FC, María GE, Gregoria ML, Adolfo SR, José Antonio FR; Groupe HUBU-COVID-19.J Transl Autoimmun. 2021;4:100086. doi: 10.1016/j.jtauto.2021.100086. Publication en ligne du 12 février 2021.PMID : 33615209 Article PMC gratuit. Revoir.
Voir tous les articles similaires
Cité par 136 articles
Beyrampour-Basmenj H, Milani M, Ebrahimi-Kalan A, Ben Taleb Z, Ward KD, Dargahi Abbasabad G, Aliyari-Serej Z, Ebrahimi Kalan M.Santé publique Rév. 2021 17 juin;42:1604061. doi: 10.3389/phrs.2021.1604061. Collection électronique 2021.PMID : 34381626 Article PMC gratuit. Revoir.
Ali GA, Husain A, Salah H, Goravey W.IDCas. 2021;25:e01244. doi: 10.1016/j.idcr.2021.e01244. Publication en ligne du 3 août 2021.PMID : 34367918 Article PMC gratuit.
Conti V, Corbi G, Sellitto C, Sabbatino F, Maci C, Bertini N, De Bellis E, Iuliano A, Davinelli S, Pagliano P, Filippelli A.J Pers Med. 1 juillet 2021;11(7):628. doi: 10.3390/jpm11070628.PMID : 34357095 Article PMC gratuit.
Aperçu des caractéristiques virologiques et immunologiques du SRAS-COV-2.
Polat C, Ergunay K.Cas du monde J Clin. 6 juillet 2021; 9 (19): 5007-5018. doi: 10.12998/wjcc.v9.i19.5007.PMID : 34307551 Article PMC gratuit. Revoir.
Behal M, Barlow B, Mefford B, Thompson Bastin ML, Donaldson JC, Laine M, Bissell BD.Explorateur de soins critiques. 13 juillet 2021;3(7):e0492. doi: 10.1097/CCE.0000000000000492. eCollection 2021 juil.PMID : 34278319 Article PMC gratuit. Revoir.
Voir tous les articles « Cité par »
L’Agence européenne des médicaments teste l’anti-inflammatoire RoActemra qui pourra être utilisé pour traiter dans les hôpitaux les patients adultes atteints de formes sévères du Covid. Bien que le coût de la molécule soit assez élevé, «trop de vies sont en jeu», prévient Médecins sans frontières.
Un médicament récemment qualifié par l’OMS de «porteurs d’espoir» pour les patients atteints de formes graves du Covid est en train d’être évalué par l’Agence européenne des médicaments (EMA). Il s’agit du RoActemra, anti-inflammatoire et antagoniste de l’interleukine 6, déjà connu et autorisé pour des maladies rhumatologiques.
«RoActemra est considéré comme un traitement potentiel pour le Covid-19 en raison de sa capacité à bloquer l’action de l’interleukine-6, une substance produite par le système immunitaire du corps en réponse à l’inflammation, qui joue un rôle important dans le Covid-19», explique l’EMA dans un communiqué du 16 août.
En cas d’autorisation, le RoActemra pourra être utilisé au sein des hôpitaux pour traiter des patients adultes atteints de formes graves du Covid qui ont déjà reçu un traitement de corticoïdes et ont été placés sous oxygène.
L’EMA procède actuellement à une évaluation accélérée du produit, dont les résultats seront communiqués «d’ici la mi-octobre, à moins que des informations supplémentaires ne soient nécessaires».
Le médicament
Le tocilizumab, substance active du RoActemra, appartient à la classe des médicaments appelés anticorps monoclonaux, utilisés dans le traitement de diverses maladies, y compris les cancers. En ce qui concerne le RoActemra, il est autorisé au sein de l’Union européenne depuis 2009 pour le traitement de la polyarthrite rhumatoïde.
En juillet 2021 l’Organisation mondiale de Santé a officiellement recommandé de recourir au tocilizumab pour «sauver la vie» des patients atteints de formes sévères du Covid. Ce médicament est le deuxième à être préconisé par l’OMS pour le traitement du Covid-19, après la dexaméthasone en septembre 2020.
D’après l’organisation, chez les patients atteints d’une forme grave ou critique du Covid-19, l’administration de tocilizumab réduit de 13% le risque de décès par rapport aux traitements standards. Et la probabilité de devoir procéder à une ventilation mécanique est réduite de 28%.
Les prix inabordables
Pour l’instant, le groupe pharmaceutique suisse Roche reste le seul producteur mondial du RoActemra, et le prix du médicament est élevé. Selon l’association Médecins sans frontières (MSF), le laboratoire suisse maintient le prix du RoActemra à 410 dollars en Australie, 646 dollars en Inde, à 3.625 dollars aux États-Unis par dose de 600 mg pour le Covid-19.
«Ces médicaments [le tocilizumab, le sarilumab] sont porteurs d’espoir pour les patients et leur famille, qui sont confrontés aux conséquences dramatiques des formes graves et critiques de Covid-19. Mais les antagonistes de l’interleukine 6 restent inaccessibles et inabordables pour la majeure partie de la population mondiale», soulignait en juillet Tedros Adhanom Ghebreyesus, directeur général de l’OMS.
L’organisation a appelé les entreprises à conclure des accords de licences non exclusifs ou à renoncer aux droits d’exclusivité.
Un message que partage MSF, qui exhorte Roche à «mettre fin à son monopole» pour que d’autres fabricants puissent produire le RoActemra.
«Ce médicament pourrait devenir essentiel pour traiter les personnes atteintes de cas critiques et sévères de Covid-19 et réduire le besoin de ventilateurs et d’oxygène médical qui sont des ressources rares dans de nombreux endroits. Roche doit cesser de suivre une approche de business-as-usual et prendre des mesures urgentes pour rendre ce médicament accessible et abordable pour tous ceux qui en ont besoin, en réduisant le prix et en transférant la technologie, le savoir-faire et les lignées cellulaires à d’autres fabricants. Trop de vies sont en jeu», a déclaré l’association le 7 juillet réagissant à la recommandation de l’OMS.
Traitement autorisé dans l’UE
Outre le RoActemra, l’autre antagoniste de l’interleukine 6, le Kineret (qui contient la substance active anakira), est actuellement à l’étude au sein de l’EMA en vue d’une autorisation commerciale. Le Veklury (remdesivir) est déjà autorisé dans l’UE.
Parmi les molécules anti-Covid soumises auprès de l’EMA à un examen continu figurent deux nouveaux anticorps monoclonaux antiviraux, le casivirimab et l’imdevimab, ainsi que quatre autres médicaments.
Visas pour des vaccinés en Chine
La Chine est, elle, sur le point d’alléger les restrictions d’entrée sur son territoire concernant les ressortissants de certains pays, dont les Etats-Unis, mais à condition qu’ils aient reçu un vaccin chinois.
Au Brésil, où le manque de doses ralentit la campagne d’immunisation, le président Jair Bolsonaro – très critiqué pour sa gestion chaotique de la crise sanitaire – a encore changé de ministre de la Santé lundi, remerciant Eduardo Pazuello.
M. Pazuello venait d’annoncer la commande de 138 millions de doses de vaccins pour accélérer une campagne d’immunisation trop lente, alors que la pandémie s’aggrave au Brésil, deuxième pays le plus endeuillé avec près de 280.000 morts.
En Europe, l’arrivée d’une troisième vague de Covid-19 a contraint l’Italie à reconfiner lundi les trois quarts de son territoire.
Elle suscite aussi des inquiétudes en Allemagne et en France, laissant planer le spectre de nouvelles restrictions.
Le président Emmanuel Macron a annoncé qu’il y aurait « dans les jours qui viennent sans doute de nouvelles décisions » pour lutter contre l’épidémie.
Les autorités sanitaires françaises ont annoncé lundi la détection d’un nouveau variant en Bretagne, dans l’ouest du pays, précisant que des investigations étaient en cours pour en évaluer la transmissibilité et la sévérité.